1999年の感染症法改正の時に、山内先生と2人して獣医学の代表として感染症法改正の審議会に参加しました。人獣共通感染症はヒトの感染症法に組み込まれることになりました。東大を定年退官した後、北里大学に「新設された人獣共通感染症研究室」に赴任しました、北里大学を定年退官した後、千葉科学大学に「新設された動物危機管理学科」で、動物危機管理学や進化免疫学、病原体の科学と人獣共通感染症を教えてきました。千葉科学大学の後、半世紀ぶりに「新設された今治キャンパスの獣医学部」で「人獣共通感染症学」を教えることになりました。学生時代は病理学を、ドイツの留学時代はウイルス学、東大の医科研時代はウイルス学と免疫学を、東大では実験動物学と毒性学を教え、北里大学では家禽疾病学や免疫学を教えてきましたが、こうしてみると「人獣共通感染症学」が一番長く教えてきた科目になります。
新型コロナウイルス感染症のために遠隔教育になり、VODを作成することになりました。昨年、コロナの前からVOD化を少しづつ始めていましたが、今回15回すべてをVOD化することができました。総数33本になりましたが、学生さんがいつでもどこでも予習・復習できるようにアップしておきます。前座はFD(ファカルティ・ディベロップメント)で、教職員用に講義の全体の概要を説明したものです。
人獣共通感染症1回1原論 https://www.youtube.com/watch?v=A0nhlUU85F4
人獣共通感染症1回2人類史 https://www.youtube.com/watch?v=7zJkWIJ7MFI
人獣共通感染症1回3文明 https://www.youtube.com/watch?v=naZP4OYEKgk
人獣共通感染症2回1疫学 https://www.youtube.com/watch?v=krobBmALmuQ
人獣共通感染症2回2監視 https://www.youtube.com/watch?v=pq_35o0Y55k
人獣共通感染症2回3新興感染https://www.youtube.com/watch?v=AWHVPMXhvI8
人獣共通感染峰2回4危機管理https://www.youtube.com/watch?v=1NvfzvKiM9A
人獣3回1伴侶輸入動物 https://www.youtube.com/watch?v=NTTxuVsE_2M
人獣3回2伴侶ヒト由来 https://www.youtube.com/watch?v=8j1OI96F7QE
人獣3回3伴侶細菌原虫 https://www.youtube.com/watch?v=N3A8U4C-spM
人獣3回4伴侶真菌寄生虫 https://www.youtube.com/watch?v=KJ6ljMs5T2U
人獣4回1産業ウイルス https://www.youtube.com/watch?v=zFzMiu4nPnM
人獣4回2産業細菌 https://www.youtube.com/watch?v=5DyP_PhPCEk
人獣5回1齧歯イントロ https://www.youtube.com/watch?v=j5rPRQUYHNw
人獣5回2齧歯ウイルス https://www.youtube.com/watch?v=HhNvf0yfidQ
人獣5回3齧歯類細菌 https://www.youtube.com/watch?v=xO7laH-kjfk
人獣6回1翼手ヘニパhttps://www.youtube.com/watch?v=EJ0HShVGDLI&t=34s
人獣6回2翼手コロナhttps://www.youtube.com/watch?v=kh-agiiTmWM&t=5s
人獣6回3翼手フィロ https://www.youtube.com/watch?v=O3jn9JkoR7o
人獣7回霊長類 https://www.youtube.com/watch?v=FHNTQzVIv5U
人獣8回1鳥類ウイルス https://www.youtube.com/watch?v=8hIPSXX7WEI
人獣8回2鳥類細菌 https://www.youtube.com/watch?v=LFub1ACmbO0
人獣9回1ウイルス特性 https://www.youtube.com/watch?v=t_f-l3CcLm8
人獣9回2ウイルス感染 https://www.youtube.com/watch?v=PVinDQyj20M
人獣10回細菌 https://www.youtube.com/watch?v=a-VWV8M4-9c
人獣11回原虫真菌他 https://www.youtube.com/watch?v=jtJ4BHvdfHc
人獣12回感染経路 https://www.youtube.com/watch?v=CrFgHuk_wgw
人獣13回1デング概論 https://www.youtube.com/watch?v=zupJvd7N9qY
人獣13回2デング疫学 https://www.youtube.com/watch?v=DMO1XvbF9S8
人獣14回1エボラ概論 https://www.youtube.com/watch?v=m9VgSXYauAs
人獣14回2エボラリスク https://www.youtube.com/watch?v=__3xq6LWCaY
人獣15回1SFTS https://www.youtube.com/watch?v=Smvltvy604k
人獣15回2コロナ社会https://www.youtube.com/watch?v=7y8DTyDPN_Y&t=16s
2017年は3年生の春学期に「人獣共通感染症」を教えることになりました。2015年、2016年とはかなり内容が変わっています。昨年の授業の議論を含めて見直しました。
第1回は、人獣共通感染症の原論として、基本概念の説明です。1年生の危機管理学入門IV、2年生の病原体の科学、動物感染症論、感染症と生体防御、3年生の動物危機管理学概論など、すべてが関連してきます。さらに、危機管理学ゼミナールで訪問した検疫所、動物愛護センター、食肉処理場などでの実地学習にも関連します。
第1回は人獣共通感染症の定義、経緯、現状からはじめ、実例として4千年の歴史を持つ「狂犬病」と歴史を変えた感染症である「ペスト」を紹介します。そして、人の感染症が動物由来であることの説明と国際的な対応について講義します。NHKのラジオ放送の第1回と第2回に相当します。
2020年コロナ感染症のために遠隔授業となりました。2019年にVODとして収録したのがあったので、一部をZOOMで編集しなおしてYou Tubeに載せることにしました。スライドは2017年当時と大分変っています。

人獣共通感染症は「人と動物の共通感染症」あるいは「動物由来感染症」、「人畜共通伝染病」、「ズーノーシス(Zoonosis)」など、いろいろな名称で呼ばれます。しかし、中身は同じです。厚生労働省は人の立場から「動物由来感染症」といいます。獣医師会は人と動物に配慮して「人と動物の共通感染症あるいは単に共通感染症」といいます。農林水産省は伝統的に「人畜共通伝染病」といい、学問的には「人獣共通感染症」と呼ばれています。
伝染病予防法を改め感染症法を制定して以来、厚生労働省は感染症という言葉を用いますが、病原体の感染によって起こる病気が感染症(infectious disease)という広い意味を持つのに対し、伝染病(contagious disease)は感染症の中でも伝搬力が強く、容易に大流行を起こしやすいものをいいます。
伝染病予防法が人から人に感染する流行病の対策を示した法律であったのに対し、感染症法は動物からヒトに感染する病気も含むこと、予防を主とし、伝染病であれ伝染性の強くない感染症であれ、患者さんの人権や保護に配慮する対策には変わりないという法の精神が感染症という言葉にこめられていると思います。感染症法の正式名称は「感染症の予防及び感染症の患者に対する医療に関する法律」です。

ルドルフ・ウイルヒョウは、学生時代に病理学で細胞病理学の祖として習った記憶があります。「生体の根源は細胞である。病気は細胞が病むことが原因である」という科学哲学として習った記憶があります。ウイルヒョウは科学者の面と政治家の面の両面をもっていました。ドイツ医学の帝王のようなアカデミーの立場と、公衆衛生のためドイツの環境衛生に尽力した政治家でもありました。科学と政治をこなした医学者といえます。
ルドルフ・ウイルヒョウの考えは、代謝病や遺伝疾患を考えるには適していますが、病原体により起こる感染症の発病病理に関しては、理解がなかったようで、ゼンメルワイスの塩素水による消毒や、ロベルト・コッホの結核菌による結核を認めなかったという説があります。Zoonosisという言葉を作ったウイルヒョウが、動物からくる感染症の病原体を考えなかったのか?少し不思議な気がします。

先日、愛媛県の松山市に行く機会がありました。ここは獣医学の巨頭である越智勇一先生(日和見感染の概念の創設者、元日本学術会議会長、元麻布大学学長など)と元国立予防衛生研究所長(現国立感染症研空所)で腸炎ビブリオやインフルエンザワクチンで活躍された福見秀雄先生(元長崎大学長)の出身地でした。松山中学の先輩である越智先生は、後に福見先生に「医学は獣医学の一部だよ」と豪語されていたという話を聞きました。カリフォルニア大のシュワーベ教授が、ヒトも動物の一つで医学は一つ(one medicine)といった提案と重なって見えます。
今は、国際的にもOne World, One Healthというマンハッタン原則に従って、医学と獣医学の連携が進んでいます。多くの先達の提言が実現化されつつあるというのが、現状でしょう。

狂犬病は歴史的にみて非常に古い「動物と人の感染症」です。既に紀元前2000年頃のエシュナンテ法典に「狂犬が人を咬んで死亡させた時、その飼い主が対価を支払う義務」について書かれています。また、1885年、ウイルスという病原微生物が理解される以前に、ルイ・パスツールによってワクチン作成の試みがなされたことでも有名です。しかし、重要なことは、この感染症が依然として現在でも世界中に広く蔓延していること、人が感染して発症した場合には有効な治療法がなく、ほぼ100%死亡すること、人と動物に対して有効なワクチンが開発されているにも拘わらず撲滅できないことです。何故でしょうか?ここから講義を始めたいと思います。
狂犬病は英語ではレイビース(rabies)といいます。専門的になりますが、狂犬病ウイルスはラブドウイルス科のリッサウイルス属に分類されます。ラブド(Rhabdo)というのは、ギリシャ語で「棒」を意味するラブドスrhabdosに由来します。電子顕微鏡で見ると、ウイルスの形が棒状に見えるため、この名が付きました。
また、レイビースの語源は、暴れ回ることを意味するラテン語のラベーレ(rabere)に由来しています。狂犬病に罹った動物や人が狂騒状態になるためにこの名が付きました。さらに、ラテン語のラベーレは、暴力をふるうことを意味する、紀元前3000年頃のサンスクリット語のラーバス(rabhas)に由来するといわれています。
さて、リッサウイルス属の名の由来ですが、これはギリシャ神話に由来します。リッサ(Lyssa)というのは女神の名前です。昔、アクタイオンという猟師がいました。彼が50頭の猟犬を連れ山で狩をしていると、偶然にも女神アルテミスの入浴中の裸体を目撃してしまったのです。

アルテミスはダイアナ、ルナという別名を持ち、月の女神で、狩の女神でもあります。また、アルテミスは処女神で、純潔の女神でもあります。激怒したアルテミスは、アクタイオンの姿を鹿に変えてしまい、彼が連れてきていた猟犬に食い殺させてしまいました。この猟犬を狂わせたのが、アルテミスに呼ばれた人を狂わせる、狂気の女神リッサでした。アルテミスは芸術家にとっても魅力的でありフォンテーヌブロー派、フェルメール、コロッジオ、ルノワールが描いていま す。また、アクタイオンの悲劇は、ティツィアーノやチェザリが描いています。
パスツールのオリジナリティーや天才的な業績(白鳥の首フラスコ、家禽コレラ菌生ワクチン、炭疽菌生(不活化)ワクチン、狂犬病ワクチンなど)については、2年生の「感染症と生体防御」のところで十分説明しました。

ペストは齧歯類から蚤を介して感染します。ツキジデスによるペロポネソス戦争の記録にアテネでのペストの流行と思われる記述があります。また、中世の市民を恐怖のどん底に陥れた「黒死病」としても有名です。中世のペストの悲惨な様子は、ボッカチオの「デカメロン(十日物語)」やカミュの「ペスト」に書かれています。
ペストの流行の歴史を振り返ると、大流行は世界史上3回知られています。6世紀ユスティニアヌス帝の時に中近東、欧州、アジアに広がった古典型、14世紀の中世の大流行を起こした地中海型と、19世紀以降の世界貿易の拡大に伴いネズミと共に世界中に蔓延した東洋型です。しかし、現在でもアフリカ、アジア、アメリカ大陸には汚染地帯が存在し、野生の齧歯類と蚤の間でペスト菌が循環しています。1980年~1994 年の15 年間に世界保健機関(WHO)に報告されたペスト患者は、24 カ国で18,739 人、死亡者は1,852 人です。世界では、毎年のように地域的な流行を起こしています。決して歴史に埋もれた過去の感染症ではありません。

人類がペストの流行から学んだもの
ペストは歴史を変えるほどの災厄を人類に及ぼしましたが、他方、感染症の統御に関するいろいろな知識を生み出しました。ペロポネソス戦争時のアテネの疫病や中世の黒死病の時に記された、「ペストから回復したヒトはペストに2度かかりしない」という免疫現象の理解は、のちの予防ワクチン開発につながる経験となりました。
また、中世の医学はヨーロッパよりも、イスラム文化圏で進んでおり、感染症が伝播することを発見したのは、イスラム圏の医学者でサーマーンのイブン・スィーナー(Ibn Sīnā)といわれています。彼が著した「医学典範(1020年)」に、患者を隔離することにより感染症の拡大を止め得ることを記述しています。イブン・アルハティーブ(Ibn al‐Khaṭīb)は14世紀のイベリア半島のペスト流行時に、汚染した衣類・食器・イヤリングへの接触が発症の有無を左右していることを発見しました。さらに、イブン・ハーティマ(Ibn Khatima, 1369年)はペストを見て、「感染症は微生物が体内に侵入することによって発症する」との仮説を打ち立てています。

ペストの流行は、海上検疫という感染症の流行を防止する新しい制度を生み出しました。検疫(quarantine)は、イタリア語のヴェネツィア方言でクアランティーナquarantena、quaranta giorni (40日間)を語源としています。1347年以後のペストの大流行時、ヴェネツィア共和国当局は、この疫病が東洋から来た船から広がることに気付きました。船内にペストの感染者がいないことを確認するため、潜伏期間に等しい40日間、疑わしい船をヴェネツィアやラグーサ港外に強制的に停泊させる措置をとりました。正式な海上検疫は1377年ベニスで始まりました。当初30日間だったのですが、不十分であるとして、後に40日に変更されました。
実際に目に見えない微生物が存在することは、「微生物学の父」と称されるオランダの商人で役人のアントニ・ファン・レーウェンフック(Antoni van Leeuwenhoek 1632-1723)が、顕微鏡によりは、多くの微生物(1674年)や精子(1677年)を発見し、記載した時に始まります。
ロバート・コッホがゼラチン等を用いた固体培地に1種類の微生物だけを純粋に分離する、純粋培養法を確立し、炭疽菌、腸チフス菌、結核菌、コレラ菌などを分離しました。また、有名な病原菌に関するコッホの4原則(1876年)を確立し、感染症の原因が細菌によることを証明しました。そして、1894年のペスト菌の分離により、疫病ペストの原因がペスト菌の感染によることが明らかにされました。ペストの有効な治療法である抗生物質の発見は1928年のフレミングによるペニシリンの発見以後になります。

ところで「感染症」とはいったい何であろうか?その病原体(細菌,真菌,原虫など)は地球上に初期に出現した生命体群で,一方,宿主(家畜やヒト)は,最後に出現したグループである。我々はこの両者の相互作用を感染症という。
しかし、地球の生命史の約半分の時間(20億年)は原核生物(真正細菌と古細菌)の世界であった。残りのさらに半分(10億年)は単細胞生物(真核生物のうち、原生生物や単細胞真菌)の世界で,気の遠くなるような長い時間,原虫群と細菌群の相互作用(感染)があったことだろう。約10億年前に多細胞生物が出現するが,高等生物はカンブリア紀(約5~6億年前)にやっと出現した。初期の生命体は新しい宿主をみつけることとなった。特に鳥類や哺乳類のような恒温動物は,病原体にとっては格好の培地であり,豊富な栄養源と安定した体温は、微生物の増殖には最適といえる。他方、また宿主もそれに対応して、より複雑な免疫系を確立することとなった(自然免疫から獲得免疫への進化は、進化免疫学で講義しています)。だが我々ヒトが登場するずっと前から,いや地球上に生命体が出現した時から,生命体間の相互作用(感染症)は存在したはずである。
生物学においては微生物(肉眼でみえない病原体群),原虫(病原性のある原生動物群?),寄生虫(宿主と共生する多細胞生物群?)という分類は存在しない。これは、生物学が生物の視点に立ち、医学が人の視点に立っていること、生物学と医学の視点が違うためであろう。動物由来感染症や家畜感染症の統御を考えると,ヒトの視点とは異なる生物学的な視点で、病原体の生態学的振る舞い(生命体の相互作用)を知る必要があるのではないだろうか? 病原体から見た人獣共通感染症という考え方は、2016年の講義から導入しました。後で説明します。

昨年は2回から人獣共通感染症の各論から入りましたが、今年は第2回に感染症の分析に必要な手技としての疫学とサーベイランスについて整理しておこうと思いました。検査とそのデータの利用は、感染症統御の基本です。さらに、検査の意味を知るためにBSEの全頭検査を例にとって紹介します。検査といってもモニタリング、サーベイランス、スクリーニングと役割は異なりますし、サーベイランスにもいろいろな目的、種類があります。今回はここを学んでください。





サーベイランスは、疾病の発生状況を正確かつ継続的に調査、把握しその情報を基に疾病の
予防と管理をはかる一連のシステムと定義されています。
アメリカ疾病予防管理センター(CDC)によるサーベイランスの目的は以下のように書かれています。①疾病の発生状況やその推移などを継続的に監視することにより、②疾病対策の企画、実施、評価に必要なデータを、③系統的に収集、分析、解釈し、④その結果を迅速に、かつ定期的に還元するものであり、⑤疾病の予防と管理を目的として用いられる。
一方、国際獣疫事務局(OIE)による定義(家畜感染症)では、①疾病対策を講じるために、
②ある集団において疾病の摘発を目的として、 ③継続的に行われる調査、となっています。CDCの定義に比べ、OIEの定義は、家畜感染症の統御を目的としており、サーベイランスの目的(摘発・淘汰?)・意義がやや狭義になっているようです。

サーベイランスには様々な方法がありますが、通常のサーベイランスは、対象を決めて監視する(特定疾患のサーベイランス)ことが多いです。この場合は、対象となった疾患が確定診断されたときに報告することになります。この方法は正確ですが、流行の発見、対応が遅れるという弱点があります。
一方、症候群サーベイランスでは、 ①特に異常がなくても、平常状態のサーベイランス(監視)を続ける。②何か変化があった場合、確定診断を待たずに症候群のレベルで報告する(例:急性熱性呼吸器症候群、急性脳炎(脳症、小頭症)など・・・)、③原因不明疾患、原因が特定できない疾患が多発した時に非常に鋭敏に、早期に発生をとらえられるという利点があります。
オリンピックやワールドカップのような国際イベントで想定外の輸入感染症のアウトブレイクが起きたとき、バイオテロなどが起きたときに有効です。
実例としては、SARSの時に、WHOは世界的規模で症候群(重症急性呼吸器症候群)のサーベイランスの実施を促しました。急性脳炎(脳症)など神経症状と発熱では西ナイル熱、ニパウイルス感染症、高病原性鳥インフルエンザ(香港)などがあります。いずれも、後になって確定診断法が確立されました。





モニタリング、スクリーニング、サーベイランスの違い。
モニタリング事例 https://en.wikipedia.org/wiki/Biomonitoring
分析化学でいうところのバイオモニタリングは、生物学的物質において毒性化学物質、その要素、またはそれらの代謝産物による身体の負担を測定することである。多くの場合、これらの測定は血液や尿に関して行われる。総人口に関する代表的なサンプルを用いて行う2つの最高に確立されたバイオモニタリングプログラムは、米国とドイツのものである。もっとも人口ベースのプログラムは、いくつかの他の国にも存在する。2001年に米国疾病管理予防センター(CDC )は、ヒトの環境化学物質への暴露に関する隔年の国家報告書すなわち米国の人口統計学的に代表的なサンプルを分析した結果を公開し始めた。環境ワーキンググループはまた、バイオモニタリング調査を実施した。
スクリーニング事例 https://en.wikipedia.org/wiki/Screening_(medicine)
医学でいうスクリーニングは、徴候や症状のない個人を対象に、まだ未診断の疾患の存在の可能性を識別するために集団に適用される戦略である。すなわち、発症前または未定の症候群の個人を対象に含み得ること、対象者は明らかに良好な健康状態であるという点でスクリーニング検査はややユニークな検査である。スクリーニング検査による介入は、集団内で早期に疾病を識別し、疾病に介入し致死率を減らすことを期待して設計されている。スクリーニングは早期診断につながる可能性もあるが、いつもスクリーニングを受ける個人の利益になるとは限らない。過剰診断、誤診、間違った安心感などの悪影響を生む可能性もある。このため、特に発生頻度の少ない疾患では、スクリーニングプログラムは高感度で高い特異性の検査が要求される。
サーベイランス事例http://www.who.int/topics/public_health_surveillance/en/
公衆衛生サーベイランスは、継続的で体系的なデータ収集と分析および公衆衛生の実践の計画、実施、評価に必要な健康関連データの解釈である。このようなサーベイランスにより以下のことができる。①差し迫った公衆衛生上の緊急事態のための早期警告システムとして機能する。②管理措置による介入の影響を文書化し、または指定された目標に向けての進捗状況を追跡する。③健康問題の疫学をモニターし明確にする。また、公衆衛生政策と戦略を決定し知らせるための優先順位を与える。

第3回からは、人獣共通感染症の各論に入ります。各カテゴリーの動物に由来する感染症を紹介します。今回は、最も身近にいるペット動物(伴侶動物)に由来する感染症です。動物看護師を目指す学生さんは、内容を理解し、自分で説明できるレベルになるよう努力してください。将来、役に立つと思います。
スライドは、最初に個人で飼っている場合に、よく見られる感染症の特徴について説明します。外表感染も内部感染も、主として常在菌(大腸菌、緑膿菌、連鎖球菌など)による感染症がほとんどです。他方、シェルター等の群飼育をしている場合の感染症は、主として伝播力の強いウイルス感染症や複合感染(多数の病原体による混合感染)です。
すなわち、同じペットの感染症でも、個別飼いの場合は、細菌感染症が多いのに対し、群飼育ではウイルス等の感染症が多くみられます。疫学でいう基本再生産数(R0:アールノート)の、群れ飼いへの影響について考えてみます。また、異種の動物を一緒に飼育する場合に、種を超えて感染症が起こる場合もあります。そうした例についても紹介します。



ここでは、輸入動物の大量死について説明します。多くは輸送中の事故や衛生管理の不手際(熱中症、水や餌の不足、ストレスなど) ですが、感染症の原因が明らかになったケースもあります。輸入ペットの大量死亡事故例、輸入ペットの病原体保有状況調査、また、輸入感染症(海外にしかな い感染症)と思われていたヒストプラズマ症(真菌感染症)が既に、わが国に侵入し、定着し始めている事例について紹介します。要点は振返りにまとめてあり ます。





メインテーマであるペット動物に由来する感染症について説明します。ウイルス、細菌、原虫、真菌、寄生虫という順番で紹介します。 ウイルス感染症は、動物間では沢山ありますが、人に感染するペット動物からのウイルス感染症は、狂犬病を除けば、ほとんどありません。ウイルスは宿主の生 きた細胞でしか増えられないので、種を超えて感染するケースが比較的少ないこと、また、国際的には野生動物由来のウイルス感染症は多いのですが、ヒトに選ばれたペット動物からくる感染症には、それほど深刻なものはないということでしょう。それだからこそ、ヒトと長く付き合ってこられたわけです。
他方、細菌感染症には多くのものがあります。細菌感染症としては、パスツレラ症、サルモネラ症、新興感染症であるカプノサイトファーガ菌感染症、コリネバ クテリウムウルセランス感染症、古くから知られているネコ引っ掻き病、オウム病、Q熱、レプトスピラについて紹介します。

ペット動物に由来する感染症は沢山ありますが、やはり細菌感染症が最も多く、主なものとしてサルモネラ症、パスツレラ症、カプノサイトファーガ症、コリネバクテリウム・ウルセランス症、ネコひっかき病、オウム病などがあります。
サルモネラ菌、パスツレラ菌などは、イヌやネコのほとんどが口腔内に持っている常在菌です。ネコは体をなめ、毛づくろいをするので爪にもこうした細菌がついていて、咬傷だけでなく引っ掻かれたときにも感染することがあります。一般の健康な人であれば重症化することはありませんが、免疫系に異常があったり、基礎疾患を持っている人が感染すると重症化します。抗生物質が有効です。
カプノサイトファーガ・カニモルサス(イヌによるかみ傷という意味、カニス(犬)とモルサス(かむこと))は、グラム陰性の桿菌で、健康なイヌやネコの歯肉の細菌叢を構成する細菌です。イヌの74%、ネコの57%が保菌しているという報告があります。イヌやネコなどによる咬傷・掻傷から感染し、発熱、倦怠感、腹痛、吐き気、頭痛などの症状を示しますが、重症例では劇症の敗血症や髄膜炎を引き起こし、播種性血管内凝固症候群や、敗血症性ショック、多臓器不全に進行して死に至ることがあります。脾臓摘出者がかかり易く、免疫機能の低下したヒト(アルコール中毒、糖尿病などの慢性疾患、免疫異常疾患、悪性腫瘍患者、高齢者など)では重症化する傾向があります。これまで46例が見つかっており、11例が死亡例です。感染は中年男性(50~60歳)が多く、死亡例はほとんどが60代男性です。理由は分かりません。治療は早期に発見し、ペニシリンやテトラサイクリンなどの抗生物質投与が有効です。
コリネバクテリウム・ウルセランス菌は最近、問題になっています。というのはこの菌のなかに、ジフテリア毒素に似た毒素を産生するものがあることがわかったからです。ペット動物ではウルセランス菌に感染し、くしゃみや鼻汁などの症状や皮膚病を示すものがありますが、無症状でウルセランス菌を保有している場合もあります。国内では、菌に感染している猫からの接触または飛沫による感染が強く疑われる例が報告されました。2001年以降、8例の報告があります。ヒトでは発熱、鼻汁など初期は鼻かぜに似た症状が出現します。その後、咽頭痛、咳などの症状が始まり、扁桃や咽頭などに小児のジフテリアの時ように偽膜が形成されます。頸部リンパ節腫脹がみられることもあります。ジフテリアと同様に、抗毒素血清療法、抗生物質投与が有効です。
ネコひっかき病の病原体は、バルトネラ・ヘンゼレでクラム陰性の桿菌です。ネコでは病気を起こしませんが、わが国ではネコの5~15%が保菌していると報告されています。ネコに引っ掻かれたり咬まれたりすることにより感染します。引っかかれた局所の腫れ、近くのリンパ節が鶏卵大に腫脹し、発熱、疲労感があります。症例の約40%はリンパ節が化膿し、重症例ではリンパ節の切開や入院が必要となります。視神経網膜炎を起こし視力障害が起こる例や肝障害を起こすこともあります。感染経路はノミからネコ、ネコからヒトの経路で感染します。ネコの血をノミが吸うとき、病原体がネコの体内に侵入し、ネコが飼い主に咬みついたり、引っ掻いたりした時、ヒトの体内へ病原菌が侵入します。一般に、自然治癒します。軽症例では経過観察のみで十分ですが、リンパ節の腫大が著しく、疼痛を認め改善しない場合は経口的に抗生物質を投与します。
オウム病の原因菌はクラミジア・シッタシで、細胞寄生性が強く、細胞内でのみ増殖するクラミジア属に分類されます。主としてオウムなど鳥類から感染しますが、2001年横浜の動物園でヘラジカの出産を介助した職員が5名感染した例が報告されています。また、2002年には島根県の動物展示施設(フォーゲル・パーク)で、放し飼いされていた鳥が原因となり、従業員と来園者の20名が集団感染しました。症型はインフルエンザ様症状を呈する異型肺炎型、肺炎型、敗血症様症状型があります。高熱で突然発症し、頭痛、全身倦怠感、筋肉痛、関節痛がみられます。呼吸器症状としては咳、血痰、チアノーゼを認める重症例もありますし、髄膜炎、多臓器障害、ショック症状を呈し致死的な経過をとることもあります。抗生物質ではテトラサイクリン系薬が第一選択薬です。



原虫は単細胞の原生動物門に属する、病原性微生物です。海外にはマラリアやレーシュマニア、トリパノソーマといった熱帯病がありま すが、先進国のペット動物に由来する重要なものとしては、クリプトスポリジウムとトキソプラズマがあります。クリプトスポリジウムは哺乳動物(家畜や野生 動物)からの水系感染(オーシスト:受精卵)は、水道の塩素濃度では不活化出来ません、またトキソプラズマの自然宿主はネコで、猫糞便のオーシストや豚肉 などのシストからの感染がよく知られています。しかし、両原虫は鳥類も感染します。今回は、その点に注目して紹介しました(詳細は鳥類由来感染症で紹介します)。真菌は前に紹介したヒストプラ ズマ症の他には、鳥類由来のクリプトコックス症が需要です。

最後は寄生虫感染症です。寄生虫は線虫、吸虫、条虫とありますが、ペット動物に由来する感染症としては線虫(犬糸状虫、アライグマ回虫、キンカジュー回虫など)と条虫(瓜実条虫と多包条虫)が問題となります。それぞれの特性と問題点と予防法について紹介します。


従来のペット動物(犬、猫、小鳥等)に由来する感染症には、それほど深刻なもの
はありません。いたずらに恐れる必要はありません。しかし、老人や小児、基礎
疾患のある人、免疫不全の人は、通常のペット動物の常在菌や病原微生物でも感染
発症し、時に重篤な経過をとることがあるので注意が必要です。
①動物との節度ある接触
②飼育の衛生管理(適正な糞尿処理)と接触後の手洗い
③飼育動物および飼い主が異常を感じたら、迅速に医師・獣医師に相談すること
が重要です。
また、野生動物や輸入動物(エキゾチックアニマル)、侵入動物(エイリアン
アニマル)はペットには向きません。危険性を認識する必要があります。
ペットショップなどでは、群飼育、異なる産地の動物、異なる種の動物を一緒に
飼育するのは出来るだけ避けたほうがいいです。

第4回は、我々の生活に近い産業動物に由来する感染症です。産業動物の場合は通常の動物由来感染症の感染経路の他に、畜産物等、食品を介した感染症があります。また、家禽も産業動物ですが、鳥類由来感染症に関しては、別途講義します。食品由来の感染症については、2年生の「動物感染症論」およびyoutubeにNHKラジオの第10回の講義(食品由来感染症)に載っています。


産業動物に由来する感染症を法律からみると、感染症法の1類に分類される感染症ではクリミア・コンゴ出血熱があります(反芻動物由来、鳥類に由来することもあるマダニが媒介)。2類には中東呼吸器症候群(MERS)があり、ヒトコブラクダからヒトへの感染が知られています。3類感染症では腸管出血性大腸菌症(EHEC)の原因となるO157は牛などの腸管に存在します。4類には鳥類由来の西ナイル熱、鳥インフルエンザ(鳥類由来感染症で紹介)、偶蹄類に由来するQ熱、炭疽、ブルセラ症、E型ウイルス肝炎、二パウイルス感染症とヘンドラウイルス感染症(コウモリ由来感染症で紹介)、日本脳炎(豚)などがあります。ウサギ目の野兎病も4類感染症です。5類の急性脳炎には東部ウマ脳炎、西部ウマ脳炎、ベネズエラウマ脳炎が含まれるます。
家畜伝染病予防法、と畜場法、食品衛生法で問題となる家畜由来感染症には、エルシニア症、カンピロバクター症、牛結核、トキソプラズマ症、トリヒナ症(旋毛虫症)、豚丹毒、鼻疽、有鉤条虫症、無鉤条虫症、リステリア症、リフトバレー熱、類鼻疽などが知られています。ここでは、主なものについて紹介します。

MERS(中東呼吸器症候群)
2012年9月、サウジアラビアのジェッダで中東呼吸器症候群(MERS)の初発例が報告されました。最初の感染者は6月13日に入院し、6月24日に死亡しました。中東地域で感染が拡大しているこの新型コロナウイルスはSARSコロナウイルスに近縁のウイルスでした。
2013年8月現在の感染者の確認地域(輸入例も含む)は、サウジアラビア、ヨルダン、カタール、UAE、イギリス、フランス、チュニジア、イタリア(疑い地域はパキスタン、ドバイ)です。2013年12月の調査結果では、潜伏期は2日~14日、肺炎が主な症状で、累計感染者数166人、死亡者数71人(死亡率42.8%)でした。2014年5月のWHOの報告では確定症例が635名で死亡例が193名、致命率は30%でした。ヒト-ヒトへの感染もありますが、家族内など限局的なものや医療関係者が巻き込まれたものです。2015年6月12日のWHOの発表によると、確定患者数は1,289人、死亡者455人で致死率は35.3%です。日本では2015年1月21日から2類感染症に分類されました。
2013年8月にMERSコロナウイルスとコウモリの関連を示す論文が発表されました。初発例の男性の自宅近くに生息する食虫コウモリ(エジプシャントゥームバット)から、患者のものと塩基配列が100%一致するウイルスが検出されたというものです。しかし、この時の材料は190塩基の遺伝子断片の解析結果でした。ヒトの臨床例から、ヒトの感染源となったラクダの血清を2回採取して、その間にMERSコロナウイルスの抗体価が上昇していたために、ラクダがウイルスに感染して間もないことが推測されました。ヨルダン、サウジアラビア、カタール、UAE、エジプトで家畜のウイルス抗体を調査したところ、ヒトコブラクダでMERSコロナウイルス抗体が検出されました。と畜場で集めた110頭の外見健康なヒトコブラクダの鼻ぬぐい液を調べた結果、4頭(3.6%)でMERSコロナウイルスの遺伝子が検出されました。しかし、と畜場の従業員179名はすべて抗体陰性でした。MERSコロナウイルスの感染がラクダから起きていることが推測されましたが、ラクダが自然宿主とは考えられていません。まだ、このウイルスの自然宿主と増幅動物、感染経路が明確になったという段階ではありません。
中東以外での「輸入感染症」はヨーロッパではイタリア、英国、オーストリア、オランダ、ギリシャ、ドイツ、フランス、トルコが、アフリカではアルジェリア、エジプト、チュニジアが、アジアではフィリピン、マレーシア、韓国、中国が、北米大陸ではアメリカ合衆国が巻き込まれています。これらの流行はすべて、中東地域への渡航歴のある人もしくはその接触者です。韓国当局は5月20日、中東帰りの68歳の男性が、MERSコロナウイルスに感染・発症したと発表しました。韓国では、他の輸入感染症を起こした国々と異なり、一気にアウトブレイクの様相を呈しています。何故、韓国でこれほど急速に感染拡大したかは明らかではありません。2015年5月20日に初発例で、約1か月後の6月17日現在、感染者162人、死亡例20人です。想定される原因として、①ウイルスの変異ですが、これは否定的です。極東のヒトがウイルス受容体の高発現・高感受性という可能性は捨てきれません。ウイルスの受容体は、DDP4別名CD26であることが確認されています。②初発患者(ゼロ号患者)さんがスーパースプレッダーであった。③対策の不備、病院のバイオセーフティー教育不備・ベンチレーション不備などです。いずれ疫学調査により、明らかにされるでしょう。










第5回からは、野生動物に由来する感染症の各論です。まず齧歯類から始めます。齧歯類は、約7,000万年前に哺乳類が分岐した時の原型といわれる長い歴史を持つ動物です。そのため、古くから種々の微生物と接触し、多くの病原体を保有しています。陸上で生活している哺乳類は、現在、約4000種います。その中で最も種の数が多く、約400属2000種、陸生哺乳類の半分の動物種が齧歯類で、極地を除く世界中に分布しています。
齧歯類で最も大きな動物は成熟個体の体重が30~60kgのカピバラです。最少は5gのトビネズミです。大きさが1万倍も違います。ほとんどの種は比較的小型で、1年間に何度も出産をするものもあり、多くは多産で、繁殖力が高いという特徴を持っています。生息域は多様です。水生、陸生、あるいは地下の巣穴にすむなど、さまざまな環境に適応しています。リスのように樹上に生息する種もあり、約35種はムササビやモモンガの仲間で木から木へ滑空することができます。齧歯類の多くが害獣です。農作物や貯蔵食物に害をあたえるほか、ドブネズミ、クマネズミなどは、ノミ、ダニなどの外部寄生虫とともに、ヒトへ感染病原体を伝播します。

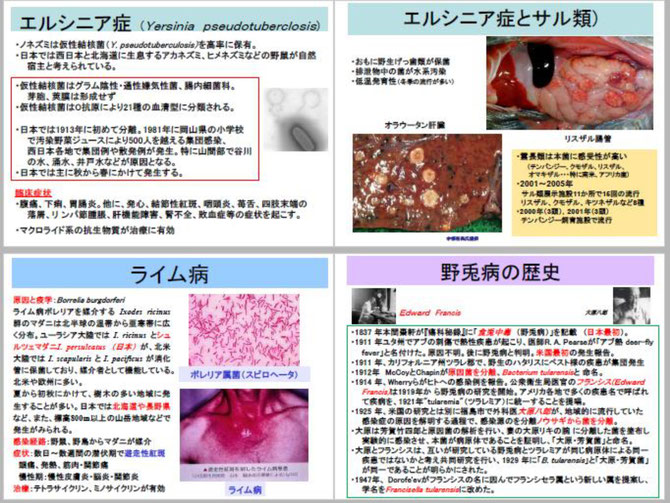
今回の講義は、感染症の専門家が問題とする重要なネズミ由来の新興感染症に焦点を絞って話します。野生齧歯類は、もちろん第1回で講義したペストをはじめ、国内で見られるレプトスピラ症、ネズミチフス菌感染症、エルシニア症(偽結核)、日本紅斑熱など沢山の細菌感染症の宿主でもあります。国際的にはさらに多くの病原体の保有動物です。
バイオテロの道具として重要な病原体(第1種から第4種)で、かつ感染症法の1類から5類に分類される疾病のうち、齧歯類が主な宿主となるものを赤字で示しました。約3分の1が齧歯類由来の感染症・病原体であるといえます。

1類感染症の南米出血熱は、それぞれアルゼンチン、ブラジル、ベネズエラ、ボリビア出血熱が含まれるアレナウイルス属のウイルスによる出血熱の総称です。典型的なウイルス出血熱で、ウイルス保有ネズミの排泄物、唾液、血液等との接触で起こります。潜伏期間は1~2週間で、初期症状として突然の発熱、筋肉痛、悪寒、背部痛、消化器症状がみられます。次いで3~4日後に衰弱、嘔吐、眩暈(めまい)が出現し、重症例では出血、高熱、ショックが認められます。歯肉からの出血が特徴的で、その後皮下や粘膜から出血が起こります。神経症状を示すこともあります。この場合には、舌や手の振戦、せん妄、昏睡、痙攣から死に至ります。死亡率は30%という高さです。
2008年、南アフリカで5名が原因不明の出血熱症状を示し、4名が死亡しました。患者の検体から新種のアレナウイルスが分離され、ルジョウイルスと命名されました。アフリカ南部でアレナウイルスによる出血熱が報告されたのはこれが初めてです。院内で2名の医療スタッフと病室の清掃員1名が感染し、発症・死亡しました。5人目の感染は二次感染者の看護師で、抗ウイルス薬のリバビリン治療を受け回復しました。
旧世界のアレナウイルスにはこの他に、イッピウイルス、モペイアウイルス、モパラウイルスなどが、新世界ではタミアミウイルス、タカリベウイルス感染症などが報告されています。流行のたびに新種のウイルスが分離されます。結局、アレナウイルス属の出血熱ウイルスは、新旧大陸に広くネズミとともに分布していることが明らかになりました。前述のハンタウイルスを含め、これらのウイルスは基本的にネズミ属の中で、親から子供に垂直感染し、子供で終生持続感染を起こし継がれていきます。



旧大陸(アジア)のウイルスで起こる「腎症候性出血熱」は潜伏期が10~30日。突然の発熱が起こり、3~7日間高熱が続きます。頭痛、悪心、脱力で始まり、第4~10病日に血圧低下やショックが起こることがあります。発病8日頃から腎の濾過機能が障害をうけ、乏尿、蛋白尿が起こります。血小板減少、腎臓機能障害による血中尿素窒素の上昇が起こり、意識障害が出現すると死亡する例が多くみられます。重症例では、蛋白尿が持続し、出血、吐血、播種性血管内凝固、血尿、尿毒症を起こし、死亡率は10%くらいです。北欧のウイルスで起こる「流行性腎症」は、腎症候性出血熱ほど重症化しません。一過性の発熱と軽度の蛋白尿が見られる程度で、死亡率は約1%です。
1938年、満州に駐屯していた日本軍に出血と腎障害を伴う急性の熱性疾患が流行し、「孫呉熱」と呼ばれました。1942年、関東軍の軍医団は「流行性出血熱」と命名しました。1951年朝鮮戦争の際に国連軍の兵士の間で出血、発熱、腎障害、嘔吐を主症状とする流行病が起き「韓国型出血熱」と呼ばれました。患者総数は3,000人以上、死亡率は5~10%でした。1982年、国際保健機関(WHO)の会議で本疾患は「腎症候性出血熱」(HFRS)とすることになりました。HFRSは中国で毎年4~6万人規模で発生しており、韓国では300~400人、欧州全域では毎年数千人以上の患者発生があるものと考えられています。全世界での年間入院患者数は15~20万人ほどであろうと推測されています。
HFRSの原因はブニヤウイルス科のハンタウイルス属、ハンターンウイルスです。ウイルスゲノムは3つのRNA遺伝子群(分節)に分かれています。各分節は、RNAゲノムを複製する酵素、ウイルス粒子の外殻を構成するエンベロープ蛋白およびゲノムRNAに結合する核蛋白をそれぞれコード(遺伝情報として書き記していること)しています。ゲノムが分断された分節構造を持つので、2つのウイルスが同時に感染すると、インフルエンザウイルスのように、各分節が交換された新型の遺伝子組換えウイルスが出現します。3つの分節ですから組み合わせは23=8通りの子孫ウイルスができることになります。
疫学的には、①セスジネズミのような野生齧歯類がウイルスを保有し、流行地域を形成しています。ネズミの多い地域の田舎や、戦争で流行地にヒトが侵入したために流行が起こる田舎型や戦争型、②都市のドブネズミやクマネズミがウイルスを保有しており、都市を中心に流行を起こす都市型、③実験動物のラットが感染源となる実験室型の3通りがあります。1960年から10年間大阪の梅田で流行した「梅田熱」は、ドブネズミやクマネズミが宿主と考えられる都市型でした。119人が感染し、2人が死亡しました。実験室での流行は、日本、ベルギー、英国、フランスで報告されています。日本ではラットを扱う実験動物の関係者が127人感染し、1人がなくなっています。
無症状でウイルスを持続的に保有している齧歯類は、糞や尿中にウイルスを排出します。そのためヒトは鼻からウイルスを吸い込む経気道感染やウイルスを含むエアロゾル(空中を漂う微小粒子)を吸い込む飛沫感染を起こします。また、ウイルスは唾液にも大量に含まれているので、咬傷によりヒトが感染することがあります。ヒトからヒトへの感染は知られていません。第4回の講義で紹介した、動物からヒトへの感染症分類ではステージ2の感染症と言えます。
治療法としては核酸に似た構造の抗ウイルス薬、リバビリン投与が有効という報告があります。何故抗ウイルス薬が核酸に似ているかは、第8回の講義、ウイルスの適応と進化の時に説明します。低血圧期やショック時には対症療法を行います。不活化ワクチンが中国、韓国で市販されていますが、日本では用いられていません。消毒用アルコールでウイルスは容易に不活化されます。

旧大陸の腎症候性出血熱の標的器官は腎臓でしたが、新大陸のネズミに由来する感染症の標的器官は肺でした。そのため、「ハンタウイルス肺症候群」と命名されました。ウイルス感染後の経過は極めて急速で、1~4日後に発熱、頭痛、悪寒が起こり、次いで強度の肺の浮腫による呼吸困難、チアノーゼがみられ、多くは、呼吸器障害の徴候がみられた後24時間以内に死亡します。肺水腫、腹水貯留、ショック死までの経過は、感染後8日以内という、驚くような早さです。死亡率は40~50%と旧大陸の感染症(HFRSや流行性腎症)に比べ極めて高くなっています。
原因はHFRSウイルスに近縁のウイルスで、「名無しウイルス(シンノンブレ・ウイルス)」と命名されました。最初の流行が1993年米国南西部のニューメキシコ、アリゾナ、ユタ、コロラド州の4州が交わる地域で起こったため、「4つのコーナーの疾病(four corners disease)」とも呼ばれました。その後の流行では、米国(34州、624例、死亡率36%)をはじめカナダ(109例、死亡率30%)、中南米のパナマ、ベネズエラ、アルゼンチン、ボリビア、ブラジルなど9か国で報告されています。ウイルスは、予想を超えて北南米大陸に広く分布していることが明らかになりました。自然宿主は野生の齧歯類で、主に北米ではシカシロアシネズミ、南米ではコトンラットやコメネズミがウイルスを保有しています。野生齧歯類からの感染経路は、新旧大陸で変わりませんが、新大陸のウイルスが肺を標的臓器にしていたために、旧大陸の腎症候群と比べて、その症状、経過、死亡率に大きな差がでたわけです。






You Tubeに講義録を載せることを覚えました。翼手目由来感染症(第6回講義2020)をアップしておきます。読むよりもわかりやすいかもしれません。講義のスライドは2020年版なので、HPとは少し違います。6回の1、2,3に分割してあります。
1はヘニパウイルス、2はコロナウイルス、3はフィロウイルスです。
https://www.youtube.com/watch?v=EJ0HShVGDLI&t=20shttps://www.youtube.com/watch?v=kh-agiiTmWM
第6回は翼手目由来の感染症です。最近、世界中を驚かせた新興感染症で自然宿主が明らかになった例を振り返ってみると、その多くがコウモリであることがわかります。コウモリが原因なのに、例えばウマから感染するヘンドラウイルス感染症、ブタから感染するニパウイルス感染症、ヨーロッパとオーストラリアのコウモリリッサウイルス感染症、また、サル類から感染したマールブルグ病やエボラ出血熱も自然宿主はコウモリと考えられています。さらにハクビシンから感染したといわれている重症急性呼吸器症候群(SARS)、あるいはラクダとともに宿主と疑われている中東呼吸器症候群(MERS)などがあります。何故コウモリがこのような役割を果たすことになったのでしょうか?そもそもコウモリとはどのような特徴を持った動物でしょうか?

コウモリは翼手目に分類されます。学名はカイロプテラ(chiroptera)です。カイロは指圧のカイロプラクティスのカイロで手という意味です。プテラはプテロザウルス、すなわち翼竜の翼という意味です。コウモリは空を飛びますが、鳥のように前足が羽になったのではなく、手の指が極端にのびて、前肢、指、後肢まで膜をはり、翼になったので「手の翼のグループ、カイロプテラ」というのです。
その特徴は、夜行性で空を飛ぶ哺乳類という点です。空を滑空する動物はマレーのヒヨケザルやムササビ、モモンガ-などいろいろあります。しかし、自力で飛行する哺乳類はコウモリだけです。コウモリの飛行移動距離は数キロから数百キロに及び、種類によっては渡りも行います。渡り鳥ならぬ渡りコウモリです。夜行性で食餌は虫を食べる食虫グループ、果物を食べる果食コウモリ、魚食いコウモリあるいは吸血コウモリなど多様です。夜の空を支配するという独自性のために、その分布は極地を除く世界全体に及んでいます。分布域は、哺乳類の最多種数を誇る齧歯類よりも広く、その化石は南極大陸以外の全大陸で発見されています。最古の化石である「夜に空を飛ぶもの」という意味の「イカロニクテルス」は、ワイオミング州のグリーンリバー で、約5300万年前の地層から見つかっています。

一口にコウモリといっても、翼手目は18科、202属、1,116種からなる大集団で、哺乳類では齧歯類についで2番目に大きなグループです。約20%がオオコウモリ亜目で80%がココウモリ亜目に属します。オオコウモリは旧大陸の亜熱帯、熱帯、熱帯雨林にのみ生息しています。コウモリの多様性は大きさでいえば、ジャワオオコウモリの体重1.5kg、翼長(広げた翼の長さ)が2mからキティブタバナコウモリの体重1.5g、翼長22cmと体重で1,000倍、翼長で10倍の差があります。群れのサイズではミミナガホウヒゲコウモリの単独生活から、メキシコオヒキコウモリやジュフロワルーセットオオコウモリのような1群数百万匹まで様々です。繁殖形態も雌雄単独、一夫一妻、一妻多夫、オオヘラコウモリのような雌集団、ウマズラコウモリのような一夫多妻、ナミチスイコウモリの多夫多妻と実に多様です。
古い歴史をもち、食物連鎖の上位に位置し、巨大な群れを作るコウモリは、侵入した病原体にとっては住みやすい環境でしょう。第4回の講義の復習になりますが、感染症の拡大・蔓延する力(R0:アールノート)は、病原体の伝搬力(β)と感受性を持つ宿主の生息密度(C)と宿主が病原体を排出する期間(D)の積になります(R0=βx Cx D)。一つの洞窟に数百万匹の老若個体が生息し繁殖する状況は、病原体にとって非常に有利です。実際、ヒトでもインフルエンザのパンデミックやポリオの大流行は20世紀に入り、巨大都市が形成され、初めて起こった流行です。

コウモリの中での病原微生物がどのようにふるまっているか、その生態は全く判っていません。ココウモリは主として洞窟で群れをなして生息しますが、オオコウモリは野外で樹木にぶら下がって生活しています。ただ、ルーセットオオコウモリだけは、例外的にエコロケーション(音波定位)能力を持ち洞窟にも野外にも生息します。病原体はココウモリとオオコウモリ、異なる種のココウモリ間、あるいはオオコウモリ間を、その生息域の共有、あるいは摂食対象の共有性などを介して行き来している可能があります。
近年、ヒトでコウモリ由来感染症が多発する原因として、自然の開発にともない、コウモリと家畜や人の住み分けが保たれなくなった事が挙げられます。後で述べる、マレーシアの二パウイルス感染症では、熱帯や熱帯雨林開発とともに家畜の飼育域がオオコウモリの生息域に入り込んだことが原因ではないかと推測されています。しかし、これまで研究されているコウモリ種はわずかであり(全種の10%くらい)、まだまだ病原体の存在も判っていません。今後も新しい翼手目由来感染症が世界を震撼させる可能は高いといえます。

1994年9月オーストラリア東部のヘンドラ地区の厩舎で突然競走馬が発症し、14頭が死亡しました。このウマでの流行中に感染馬と接触した調教師1名が死亡し、1名が発病後に回復しました。感染したウマの肺とヒトの死亡例の腎臓から、パラミクソウイルス科、へ二パウイルス属のヘンドラウイルスが分離されました。症状はヒト、ウマともに食欲不振、発熱、泡沫性鼻汁、出血性肺炎、間質性肺炎、肺水腫、チアノーゼ、四肢浮腫、運動失調などがみられました。
ヘンドラウイルスの自然宿主を明らかにするため、疫学調査が行われました。哺乳類、爬虫類、両生類、鳥類を含む46種の動物から総計5,550 の血清が検査されましたが、抗体はすべて陰性でした。また流行が約1か月でオーストラリア東部の2地区、マッケイ(1994年8月)とヘンドラ(1994年9月)で起き、両地区は800kmも離れていたので、オオコウモリや渡り鳥が疑われました。調査の結果4種類のオオコウモリがヘンドラウイルス抗体陽性であり、オオコウモリからウマに感染し、ウマからヒトに感染したと考えられました。自然宿主の候補の一つと考えられたハイガシラオオコウモリ8匹の皮下、または経鼻と経口でウイルスを接種した結果、6匹が無症状で抗体が上昇し、2匹は血管病変と高いレベルの抗体を有し、生残し、自然宿主であると結論されました。オオコウモリは常にウイルスを保有していますが、1994年から2013年までの調査では、ウマへの感染が15回、ウマからヒトへの感染が4回起こっています。


1998年9月マレーシアのペラ州イポー市で脳炎患者が多発し、翌年2月までに15名が死亡し、最終的には26名が死亡しました。1998年12月から翌年1月にヌグリ・スンビラン州で流行が始まり、2月からはアウトブレイクになりました。脳炎患者さんの93%は養豚関係者(42%は労働者、39%は経営者)でした。最初、日本脳炎が疑われましたが、成人に多く、蚊を介する日本脳炎とは流行様式が異なり、ワクチンが効かないことから別のウイルス感染症が疑われました。
1999年3月ヘンドラウイルスに類似のウイルスが分離され、スンガイ・ニパ(Sungai Nipah)村の名前を取りニパウイルスと命名されました。1999年3月~5月の流行では、224名が発症し、80名が死亡しました。疫学調査では、1998年9月~1999年3月の間に急性脳炎として登録された患者さんは265人で、そのうち死亡者は105人でした。265人のうち155人がニパウイルスに感染しており、37人がニパウイルスと日本脳炎ウイルスの両方に感染し、11人が日本脳炎ウイルスに感染するという複雑な状況でした。1999年2月~4月に4発生地域でブタ90万頭を殺処分し、汚染農場検査を進め陽性農場ではブタの全頭殺処分を行った結果、1999年5月に流行は終息しました。その後マレーシアではニパウイルスの流行は見られていません。マレーシアの例では、自然宿主のオオコウモリからニパウイルスがブタに感染し、ブタでウイルスが増幅され、ヒトに感染しました。

2001年~2013年、バングラディシュでニパウイルス感染症の散発的な流行がみられました。しかし、このケースではブタの関与はありませんでした。夜にオオコウモリが食べに来た果物がコウモリの体液で汚染され、汚染したナツメヤシなどの生ジュースによりヒトへの感染が起きたと考えられています。2004年には病院で医師1名、2010年に研修医1名が患者さんから感染し死亡しています。このケースではオオコウモリから汚染果物を介してヒトに感染し、まれにヒトからヒトに感染したと考えられます。バングラディシュでは総数179名が感染し、140名が死亡しました。また、インドでは2001年と2007年に流行(5人感染、全員死亡)が起きています。ニパウイルスが南アジアに広く分布していること、オオコウモリからブタを経てヒトという感染経路以外に、果物やヒトからヒトへの感染が起こることが明らかになりました。

2002年11月に広州市呼吸病研究所は中華人民共和国広東省で、同年7月頃から新しい急性呼吸器感染症が発生したと発表しました。40℃近くの発熱、咳、胸の痛み、肺炎、呼吸困難、重症者は死亡と経過は非常に早く進行しました。この疾病が一般に知られたのは2003年2月、香港メトロポールホテルで流行が一気に拡大した時です。香港での感染源はホテルの9階に宿泊した広東省の医師でした。彼はホテルを訪れた16人に感染させました。SARSのR0(アールノート)は3くらいです(平均1人から3人に感染を拡大する)。彼のように感染症を一気に広げるヒトをスーパ―スプレッダーといいます。高い濃度のウイルスを体内に持ち、比較的長くウイルスを排出し、他人に感染症をうつしていきます。AIDSの時には、サンフランシスコのガエタン・デュガがスーパースプレッダーとして非常に有名になりました。SARSは、その後、わずか数カ月で世界中に伝播し、2003年7月に制圧宣言が出されるまでの間に8,098人が感染し、774人が死亡しました(死亡率9.6%)。感染症は病型そのままの重症急性呼吸器症候群(SARS)と命名されました。日本では、台湾の医師が感染後、数県を回りパニックになりました。厚生労働省は1類感染症に指定し緊急対応を取りました。現在SARSは2類感染症に入れられています。
原因はSARSコロナウイルスでした。動物市場のハクビシンから発見されましたが、ハクビシンはこのウイルス感染で発症してしまうこと、特定のハクビシン以外からはウイルスが検出されなかったことから、ハクビシンは自然宿主ではないと考えられました。2005年、中国4カ所で捕獲された9種類、408匹のコウモリの血液、糞便、咽頭ぬぐい液の検査で3種類のキクガシラコウモリが抗SARSコロナウイルス抗体の保有率が高いこと(28~71%)、コウモリから検出されたウイルスは、ヒトSARSコロナウイルスの塩基配列と92%の相同性をもっており、キクガシラコウモリが自然宿主と考えられました。
ウイルスが感染するときに必要とする細胞の受容体はACE-2蛋白と同定されました。しかし、キクガシラコウモリのACE-2は受容体としての機能はなく、ヒトやハクビシンのように発症しません。一方、中国南部に生息するデマレルーセットオオコウモリのACE-2は受容体の機能を持っています。生息域を共有するキクガシラコウモリのSARSコロナウイルスが、ルーセットオオコウモリで増幅し、ハクビシンやヒトに感染する可能性も考える必要があるかもしれません。

2012年9月、サウジアラビアのジェッダで中東呼吸器症候群(MERS)の初発例が報告されました。最初の感染者は6月13日に入院し、6月24日に死亡しました。中東地域で感染が拡大しているこの新型コロナウイルスはSARSコロナウイルスに近縁のウイルスでした。
2013年8月現在の感染者の確認地域(輸入例も含む)は、サウジアラビア、ヨルダン、カタール、UAE、イギリス、フランス、チュニジア、イタリア(疑い地域はパキスタン、ドバイ)です。2013年12月の調査結果では、潜伏期は2日~14日、肺炎が主な症状で、累計感染者数166人、死亡者数71人(死亡率42.8%)でした。2014年5月のWHOの報告では確定症例が635名で死亡例が193名、致命率は30%でした。ヒト-ヒトへの感染もありますが、家族内など限局的なものや医療関係者が巻き込まれたものです。2015年6月12日のWHOの発表によると、確定患者数は1,289人、死亡者455人で致死率は35.3%です。日本では2015年1月21日から2類感染症に分類されました。
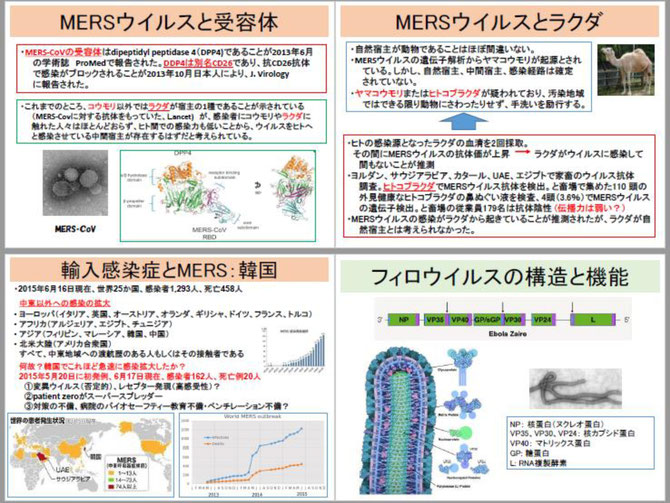
2013年8月にMERSコロナウイルスとコウモリの関連を示す論文が発表されました。初発例の男性の自宅近くに生息する食虫コウモリ(エジプシャントゥームバット)から、患者のものと塩基配列が100%一致するウイルスが検出されたというものです。しかし、この時の材料は190塩基の遺伝子断片の解析結果でした。ヒトの臨床例から、ヒトの感染源となったラクダの血清を2回採取して、その間にMERSコロナウイルスの抗体価が上昇していたために、ラクダがウイルスに感染して間もないことが推測されました。ヨルダン、サウジアラビア、カタール、UAE、エジプトで家畜のウイルス抗体を調査したところ、ヒトコブラクダでMERSコロナウイルス抗体が検出されました。と畜場で集めた110頭の外見健康なヒトコブラクダの鼻ぬぐい液を調べた結果、4頭(3.6%)でMERSコロナウイルスの遺伝子が検出されました。しかし、と畜場の従業員179名はすべて抗体陰性でした。MERSコロナウイルスの感染がラクダから起きていることが推測されましたが、ラクダが自然宿主とは考えられていません。まだ、このウイルスの自然宿主と増幅動物、感染経路が明確になったという段階ではありません。
中東以外での「輸入感染症」はヨーロッパではイタリア、英国、オーストリア、オランダ、ギリシャ、ドイツ、フランス、トルコが、アフリカではアルジェリア、エジプト、チュニジアが、アジアではフィリピン、マレーシア、韓国、中国が、北米大陸ではアメリカ合衆国が巻き込まれています。これらの流行はすべて、中東地域への渡航歴のある人もしくはその接触者です。韓国当局は5月20日、中東帰りの68歳の男性が、MERSコロナウイルスに感染・発症したと発表しました。韓国では、他の輸入感染症を起こした国々と異なり、一気にアウトブレイクの様相を呈しています。何故、韓国でこれほど急速に感染拡大したかは明らかではありません。2015年5月20日に初発例で、約1か月後の6月17日現在、感染者162人、死亡例20人です。想定される原因として、①ウイルスの変異ですが、これは否定的です。極東のヒトがウイルス受容体の高発現・高感受性という可能性は捨てきれません。ウイルスの受容体は、DDP4別名CD26であることが確認されています。②初発患者(ゼロ号患者)さんがスーパースプレッダーであった。③対策の不備、病院のバイオセーフティー教育不備・ベンチレーション不備などです。いずれ疫学調査により、明らかにされるでしょう。

アフリカには末期に全身性の出血を特徴とするフィロウイルス感染症があります。1類感染症のエボラ出血熱(エボラウイルス)とマールブルグ病(マールブルグウイルス)です。どちらもウイルスの自然宿主としてはオオコウモリが考えられています。
欧州でポリオワクチン製造などのために1967年8月ウガンダから輸入したアフリカミドリザルを介して流行が起きたのが、マールブルグ病の最初の報告です。マールブルグのベーリング研究所、フランクフルトのパウル・エールリヒ研究所とベオグラードの血清ワクチン研究所でした。合計31名が発症し、7 名が死亡しました。死亡率は22%でした。同時期に日本でも同じ業者から7, 8月に500頭輸入しましたが、幸いマールブルグ病は発生しませんでした。ウガンダから輸入されたミドリザルが、英国の空港で他のアフリカの野生動物、おそらくオオコウモリと接触し、ウイルスを伝播されたものと思われます。
その後の流行は、1960年代後半から1990年代までは小さく散発的でした。1975年に南ア連邦で3名が発病し1名が死亡、1980年にケニアで2名発症、1982年南ア、1987年ケニアで散発的な流行、1990年スエーデンの旅行者が感染、1994年ロシアで実験室内の感染が起こりました。しかし、2000年前後からマールブルグ病の流行は、大規模化する傾向がみられ、死亡率は高くなりました。1999年コンゴで大流行し、103人が感染し、69人が死亡しました。2000年にはコンゴで流行、150人が感染し、原因としてコウモリが疑われました。2004年から05年にかけてアンゴラで流行し、374人が感染し、329人が死亡しました。
マールブルグ病の潜伏期間は3日〜10日で、突然の発熱、頭痛、筋肉痛、皮膚・粘膜での発疹などが初期にみられます。激しい嘔吐が繰り返され、1~2日して水様性下痢がみられます。皮膚の発疹は特徴的で、発症後5~7日で胴体部、臀部、上肢などに境界明瞭な留針の頭部大の暗赤色の丘疹が出現します。重症例では散在性に暗赤色の紅斑が顔面、胴体、四肢に認められます。死亡率は25%位です。
マールブルクウイルスの自然宿主については、2007年にアフリカのオオコウモリが感染の媒介となっていることをガボンと米国の研究チームが突き止めました。ガボンとコンゴ共和国で2005年と2006年に採集したルーセットオオコウモリ283匹のうち4匹からマールブルグ病ウイルスの遺伝子を検出しました。また、同種のコウモリ29匹で抗体陽性が確認されました。霊長類以外で自然感染による陽性反応が出たのは、これが初めてでした。全部で10種類のコウモリ1,100匹について調査しましたが、他の種のコウモリからは、マールブルグ病のウイルス遺伝子も抗体も検出されませんでした 。

エボラ出血熱は、1976年にスーダンのヌザラとザイール(現コンゴ民主共和国)のエボラ川の近くのヤンプク村での流行が最初です。エボラウイルスは、この川の名前にちなんで名づけられました。マールブルグウイルスが1株なのに対し、エボラウイルスは現在までに5株が分離されています。4株はアフリカ由来でヒトに致命的な感染を起こします。ザイール株、スーダン株、コートジボワール(タイフォレスト)株、ブンディブギョ株です。エボラウイルスの流行では、野生のチンパンジーが感染し、群れのチンパンジーが絶滅する危惧を持たれたケースや、チンパンジーからヒトに感染したケースなども報告されています。エボラ出血熱は、最初の流行からその規模は比較的大きなものでした。
1976年スーダンでの流行は、284例が感染し、死亡率は53%でした。同年のザイールの流行では318例が感染し、死亡率は88%という高率でした。1994年タイフォレスト株では、チンパンジーが12例感染し、解剖した1人が感染しました。1995年コンゴの流行では315例感染し、死亡率は77%、1996 年のガボンでは91例感染、死亡率70%という状況でした。2000年~2001年のウガンダでは425例感染、224例が死亡、ガボンでは124例感染、69例が死亡しました。その後もほぼ毎年流行が起きています。2007年ウガンダで新種のエボラウイルスによる流行が起きました(ブンディブギョ株)。ウガンダ、ブンディブギョで流行し、37人が死亡しました。2008年の米国疾病予防管理センター(CDC)の発表では、致死率は36%以下で80~90%のザイール株、50~55%のスーダン株より低いこと、既存の株と比べて塩基配列が30%以上も異なるという別の流行株でした。
アジアの1株は、レストン株でサル類に致命的な感染を起こしますが、なぜかヒトでは感染しても発症しません。サル類での流行は、いずれもフィリピンのサル類繁殖施設から輸出されたカニクイザルでみられました。1989年バージニア、レストンでの流行が最初で、1990年にテキサス州のアリス、1992年にイタリアのシエナ、1996年にアリスとフィリピンでカニクイザルの間で流行がみられました。

私は、1996年のフィリピンのサル施設におけるレストン株の流行後にフィリピン熱帯医学研究所、フィリピン大学獣医学部と共同研究を始めました。サル繁殖施設での流行疫学、ミンダナオ島のカニクイザルの疫学調査から初めて、その後、野生コウモリに標的を変えました。そして2001年には、我々のグループがこのウイルスの全遺伝子配列を明らかにしました。また、2011年には多くのフィリピンコウモリの血清を調べた結果、ジュフロワルーセットオオコウモリのみが抗体を持っており、自然宿主である可能性が示唆されました。その後、中東のデマレルーセットオオコウモリがやはり、フィロウイルス抗体を持っていることが報告され、アフリカ、中東、アジアの別種のルーセットオオコウモリが、それぞれ抗体陽性であることが明らかになりました。

1997年に政府がフィリピンのサル繁殖施設の閉鎖を命じた後、流行はありませんでしたが、2008年、米国でエボラレストンウイルスがフィリピンのブタから分離されました。これまでエボラウイルスはコウモリ以外ではヒトを含む霊長類しか自然感染しないと考えられていたので、非常に驚きました。しかし、翼手目と有蹄類は遺伝的には近いので、ニパウイルスのように、コウモリからブタに感染することはあり得ることかもしれません。

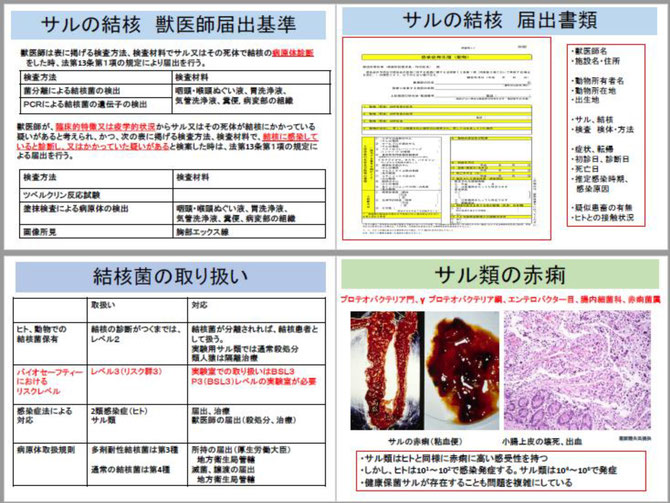
第7回は、野生動物由来感染症のうちヒトに近い霊長類に由来ゆらいする感染症を講義します。サル類は人に近いので、人獣共通感染症の名のとおり、ヒトからサル類に感染する感染症とサル類から人に感染する感染症があります。














人獣共通感染症の第8回は、動物各論の最後です。ここでは鳥類に由来する人獣共通感染症を紹介します。鳥類は哺乳類と比べて、ヒトに来る感染症の頻度も、種類も多くありません。系統樹が離れていること、家禽を除けば、特に野鳥はヒトと住み分けていてペットや家畜のようにヒトと接触する機会が少ないことも理由の一つでしょう。
それでも鳥類由来のウイルス病、細菌感染症、真菌感染症には重要なものがあります。













これで各種動物に由来する感染症はすべて述べました。次回からは、病原体の側に立って人獣共通感染症を考えてみましょう。これは3年生の学生さんにパワーポイントで発表してもらった時に気づいた新しい問題です。それまで、人獣共通感染症の教科書のように動物に由来する病原体だけ教えてきたのですが、同じグループの病原体でヒトにも動物にもあるのに、動物から容易にヒトに感染する病原体と、ヒトに感染しない病原体にはどのような特徴的な差があるのか?という問題です。
いつも当たりくじばかり教えていたので、外れくじと当たりくじの違いを考える機会がありませんでした。学生さんの素直な目でみた発表から、気が付きました。ウイルスから寄生虫まで、講義の内容が毎年充実してきました。まだ発展途上です(今年2017年は、真菌類の特性の解析がすすみました)。

学生さんと、もう一回、人獣共通感染症の病原体としてのウイルスというものを考えてみようというので、学生さんにデータを纏め、発表してもらいました。学生さんは素直なので、人獣共通感染症の原因ウイルスにこだわらないでウイルスのレビューをしてきました。これが僕にとっては目からうろこの落ちる結果でした。というのは、僕らが教える人獣共通感染症の微生物は当たり前で、ウイルスも細菌も寄生虫も動物からヒトに来る病原体だけを教えるわけですから、100%、当たりくじの特性を教えているわけです。けれども、そういう考えを忘れて、もう一回、ウイルスというものを見てみたのです。



横軸がゲノムサイズです。縦軸がウイルスの粒子の大きさです。こうやって見ると、DNAウイルスというのは、ものすごく大きな多様性を持っていて、一番大きいのがポックスウイルス、次がヘルペスウイルスです。ポックスウイルスは200近い遺伝子を持った大型ウイルスです(メガウイルス群を除く既存の病原性ウイルスでは最大)。ヘルペスウイルスの遺伝子は100個くらいです。他方、一番小さいのはパルボウイルスで、粒子の大きさは25ナノメートルしかありません。遺伝子も2個です。DNAウイルスは、大から小まで、この直線状に乗っています。
一方、RNAのウイルスは、ダブルストランド(2本鎖)なのはレオウイルスとビルナウイルスで、シングルストランド(1本鎖)にはプラスストランド(+鎖)とマイナスストランド(-鎖)のウイルスがいます。そのままメッセンジャーになってタンパク質に読んでいけるゲノム(+鎖)を持っているものと、一回、マイナスからプラスに読まないとタンパク質合成ができないグループがいるわけです。プラス鎖のRNAウイルスで一番大きいのがコロナウイルスです。大体、ヘルペスウイルスの半分以下の大きさです。そして、+鎖のRNAウイルスで一番小さいのはポリオウイルスや口蹄疫ウイルスを含めたピコルナウイルスです。ある程度の多様性があるのですけれども、DNAウイルスほどの大きさの多様性はありません。
さらに驚いたことに、マイナスストランド(-鎖)のRNAウイルスというのは、ほとんど多様性がなく、差がありません。一番大きいのがパラミクソウイルス、一番小さいのがオルソミクソウイルスですから、麻疹とインフルエンザのウイルスがそんなに変わるはずがありません。遺伝子は8~10個くらいです。それぞれのウイルスグループには、このような特徴があります。


さて、最初に学生さんが持ってきたのが、大きいものから小さいものまで並べて、DNAのウイルス一覧を持ってきました。いつも僕らには、確かにサル痘とかパラポックスとかヤバポックスとか、ポックスウイルスが容易に動物からヒトに来るというように教えています。それから、ヘルペスウイルスを教えるときには、いつも動物由来感染症の例としてBウイルスを教えます。しかし、この2種類の大型DNAウイルスよりも小型のウイルスは違います。比較的小型のDNAウイルス、アデノウイルス、パポーバウイルス、パピローマウイルス、それから小型のパルボウイルス、ヘパドナウイルスなど、ここに入ってくる中型から小型のDNAウイルスは、動物もヒトにもウイルスはあるにもかかわらず、動物からヒトに来るウイルスはほとんど知られていません。
これは僕にとっては非常にショッキングな結果でした。いつも教えるのは、陽性例ばかりですから、当然、これらのウイルスの中にも、大型のウイルスと同じぐらいの頻度で動物からヒトに来るウイルスがいるとアプリオリに考えていました。例えば、アデノウイルスは、ヒトでは49種類も既にヒトのウイルスを持っています。ヒトに来ているにもかかわらず、現時点で、サルから鳥類、魚類など、みんな自分のアデノウイルスを持っているのに、種を超えてくるというものが知られていないというのは、どういうことなのだろうか?ということです。


このルールは一般的なのかというので、今度は自分でやってみたのです。+鎖のRNAウイルスで一番大きいコロナウイルスは、SARSやMERSウイルスのグループで、動物由来感染症を起こします。それから、レトロウイルスは逆転写酵素を持っているので多少事情は違いますが、白血病ウイルスやエイズのウイルスのグループでやはり種を超えてヒトにきます。トガウイルス、フラビウイルスなど、この辺の中型の大きさのウイルスまでは、確かに動物からヒトに来ます。しかし、小型の+鎖RNAウイルスに入って、カリシウイルス科ではノロウイルスだけがヒトにきます。けれども、これはもともとヒトのウイルスが腸管でふえて海まで行って二枚貝で濃縮され、ヒトに戻ってくるので、動物由来というべきではないかもしれません。それより小さい+鎖RNAウイルスは、ほとんどヒトには来ないということです。



さらに、ここでびっくりしたのが、RNAのマイナ鎖ウイルスです。これは、パラミクソウイルスからラブドウイルス、ブニアウイルス、アレナウイルス、フィロウイルス、オルソミクソウイルス科、知られている全ての科のウイルスが動物からヒトに来ます。だから、僕らがウイルスによる人獣共通感染症を教える時は、ほとんどは、ここのウイルスグループに集中しているのです。RNAのマイナスストランド(-鎖)のウイルスは極めて均一で、ゲノム構造は最初言ったように多様性がなくて、ほとんど8個~10個くらいの遺伝子からできています。基本的にはゲノム構造が類似しており、全ての科のものがヒトに来るという特性を持っています。

これは何だろうか?ということを考えてみました。人獣共通感染症を起こすウイルスの特性というのを自分なりに、もう一回、誰もこんなことを考えたことがなかったので、分かったことをルール化してみようと考えました。
そうすると、まず1番目はゲノムの大きさが問題だということです。大きいウイルスのほうが小さいウイルスよりも種を超えやすい。当たり前で、200の遺伝子を持っているポックスウイルスと2個しか遺伝子を持っていないパルボウイルスを比べれば、ウイルスは生きた細胞からタンパク質を借りて増殖するわけですから、もし2個の遺伝子のウイルスが種を超えようとすると、198種類のタンパク質をAの動物からBの動物に乗り換えても使えなくてはいけないということになります。これを考えると、小さいウイルスは宿主からの借り物のタンパク質が多くなればなるほど、一旦、その宿主に適応したら宿主を変えにくいだろうというルールは成り立つかもしれないと思います。
また、ウイルスが種を超えるためには変異が必要なので、ゲノムの安定性に関しては、安定なほど逆に言えば種を超えにくいわけで、変異の少ないウイルスは新しい環境に適応しにくいから宿主を変えない。そうすると、2本鎖よりも1本鎖のゲノムのほうが不安定ですから種を超えやすいし、DNAよりもRNAのウイルスのほうが有利になるだろうということになります。
それから、独自の複製酵素を持つほうが自由度が高いので、小型のDNAウイルスでは、もう自分の複製酵素を持たないで、ヒトならヒトのDNAの複製酵素を借りているので、これはもうほとんど、宿主が定着したら、その宿主の動物種にはまってしまうことになります。種を超えて感染することは非常に難しい。
また、ゲノムが分節して遺伝子ごとに分かれているウイルスは、インフルエンザウイルスみたいにリアソート(遺伝子再集合)しますから、点突然変異ではなくて突然遺伝子を丸ごと入れかえることができるので、全く新規のゲノムを構成できます。そのため、場合によったら宿主の動物の分類で目とか科とか属を超えても、かなり離れても一気超えていく可能性があります。
最後に、自然宿主とヒトの遺伝的距離を考えると、ヒトと遺伝的距離が近い動物を宿主に持つウイルスは、当然、ヒトに感染しやすいという特性を持っています。

この五つルールを読み取って人獣共通感染症のウイルスのリスクを考えてみようと思ったのが、下の図です。まだ完成域ではないのですけれども。横軸に、ウイルスゲノム構造をとっています。DNAのほうがより安定で、RNAのほうが不安定なので、そのように並べてあります。縦軸はサイズの大きいものからサイズの小さいもの、自分の複製酵素を持っているものから自分の複製酵素を持っていないものなどを含めて、はめ込んでみました。原点に近いほど宿主を換えられないということです。原点から離れるほど、リスクが高いわけです。

そういう形で宿主域を含めて表をつくってみると、トップにいるのが、現存している限りはコロナウイルスとレオウイルスです。それから、次に来るのがポックスウイルス、ヘルペスウイルス、それからプラス・マイナス鎖のRNAウイルスではアレナウイルスとかブニアウイルス、オルソミクソウイルス、トガウイルス、フラビウイルス、レトロウイルス、ラブドウイルス、フィロウイルスです。この辺がいつも登場する人獣共通感染症の病原体です。それより少し来にくいのがアデノウイルスとかヘペウイルスとかカリキウイルス、アストロウイルスです。ほとんど種を超えて来ないと思われるのがヘパドナウイルスとかパルボウイルス、パポーバウイルスといったウイルスだろうということになります。

人獣共通感染症2へ続きます。
 吉川泰弘の
ホームページへようこそ!
吉川泰弘の
ホームページへようこそ!








