「新型コロナウイルス(COVID19)」感染症については、コウモリ由来と考えられますが、このホームページの「コロナウイルス感染症」:コロナウイル新興感染症を学ぶ、に別途、まとめて書きました。SARSやMERSとの関連を知りたい方は、最初から見てください。新型コロナウイルスだけでいい方は、COVID19のスライドから見てください。
コウモリ由来の感染症については、3年人獣共通感染症に載せていますが、アクセスしにくいようですので、リニューアルしてここに再掲します。従来の「コウモリで発見された新しい?インフルエンザウイルス」などについては、この後に載せてあります。
最近、世界中を驚かせた新興感染症で自然宿主が明らかになった例を振り返ってみると、その多くがコウモリであることがわかります。コウモリが原因なのに、例えばウマから感染するオーストラリアのヘンドラウイルス感染症、ブタから感染したマレーシアのニパウイルス感染症、ヨーロッパとオーストラリア、アフリカ、中近東、ロシアのコウモリリッサウイルス感染症、また、ヨーロッパでサル類から感染したマールブルグ病やアフリカのエボラ出血熱、アジアのエボラレストン株も自然宿主はコウモリと考えられています。さらに中国でハクビシンから感染したといわれている重症急性呼吸器症候群(SARS)、あるいは中近東でラクダとともに宿主と疑われている中東呼吸器症候群(MERS)などがあります。何故コウモリがこのような役割を果たすことになったのでしょうか?そもそもコウモリとはどのような特徴を持った動物でしょうか?ここから講義を始めましょう。

コウモリは翼手目に分類されます。学名はカイロプテラ(chiroptera) です。カイロは指圧のカイロプラクティスのカイロで手という意味です。プテラはプテロザウルス、すなわち翼竜の翼という意味です。コウモリは空を飛びますが、鳥のように前足が羽になったのではなく、手の指が極端にのびて、前肢、指、後肢まで膜をはり、翼になったので「手の翼のグループ、カイロプテラ」というのです。
その特徴は、夜行性で空を飛ぶ哺乳類という点です。空を滑空する動物はマレーのヒヨケザルやムササビ、モモンガ-などいろいろあります。しかし、高所から滑空(グライディング)するのではなく、自力で飛行する哺乳類はコウモリだけです。コウモリの飛行移動距離は数キロから数百キロに及び、種類によっては渡りも行います。渡り鳥ならぬ渡りコウモリです。夜行性で食餌は虫を食べる食虫グループ、果物を食べる果食コウモリ、魚食いコウモリあるいは吸血コウモリなど多様です。夜の空を支配するという独自性のために、その分布は極地(北極、南極)を除く世界全体に及んでいます。分布域は、哺乳類の最多種数を誇る齧歯類よりも広く、その化石は南極大陸以外の全大陸で発見されています。最古の化石である「夜に空を飛ぶもの」という意味の「イカロニクテリス」(イカロスは蠟の羽で空を飛んだクレタ島ミノス王の神話に出てくる青年、ニクテリスはフォトジェンの夜の少女です)は、ワイオミング州のグリーンリバー で、約5300万年前の地層から見つかっています。

一口にコウモリといっても、翼手目は18科、202属、1,116種からなる大集団で、哺乳類では齧歯類についで2番目に大きなグループです。約20%がオオコウモリ亜目で、80%がココウモリ亜目に属します。オオコウモリは旧大陸の亜熱帯、熱帯、熱帯雨林にのみ生息しています。コウモリの多様性は大きさでいえば、最大であるジャワオオコウモリの体重1.5kg、翼長(広げた翼の長さ)が2mから、最小であるキティブタバナコウモリの体重1.5g、翼長22cmまであり、体重で1,000倍、翼長で10倍の差があります。群れのサイズではミミナガホウヒゲコウモリの単独生活から、メキシコオヒキコウモリやジュフロワルーセットオオコウモリのような1群数百万匹まで様々です。繁殖形態も雌雄単独、一夫一妻、一妻多夫、オオヘラコウモリのような雌集団、ウマズラコウモリのような一夫多妻、ナミチスイコウモリの多夫多妻と実に多様です。
古い歴史をもち、食物連鎖の上位に位置し、巨大な群れを作るコウモリは、侵入した病原体にとっては住みやすい環境でしょう。感染症の拡大・蔓延する力(R0:アールノート)は、病原体の伝搬力(β)と感受性を持つ宿主の生息密度(C)と宿主が病原体を排出する期間(D)の積になります(R0=βx Cx D)。一つの洞窟に数百万匹の老若個体が生息し繁殖する状況は、病原体にとって非常に有利です。実際、ヒトでもインフルエンザのパンデミックやポリオの大流行は20世紀に入り、巨大都市が形成され、初めて起こった流行です。

オオコウモリとココウモリは生態も形態も違います。特にオオコウモリは霊長類のように両眼視を行い、指も親指と残りの指が向き合っています。また耳介と頭蓋骨はつながっています。目が大きく鼻が伸びており、フライングフォックス(空飛ぶキツネ)の名があります。花の蜜などを好んで食べるベジタリアンです。ココウモリは超音波のエコロケーションで蚊のような昆虫を捕食する食虫動物であり(魚や血を吸うウオクイコウモリやチスイコウモリもいる)、耳介と頭蓋骨は分離しており、単眼視で洞窟に群れをなして生活する。そのため、両者は空を飛んだ霊長類と空を飛んだ食虫目と考えられた時代もありましたが、現在では、遺伝子解析や分子生物学の発展により、1系統で、ココウモリからオオコウモリが分岐したと考えられています。
コウモリの中での病原微生物がどのようにふるまっているか、その生態は全く判っていません。ココウモリは主として洞窟で群れをなして生息しますが、オオコウモリは野外で樹木にぶら下がって生活しています。ただし、ルーセットオオコウモリだけは、例外的にエコロケーション(音波定位)能力を持ち洞窟にも野外にも生息します。病原体はココウモリとオオコウモリ、異なる種のココウモリ間、あるいはオオコウモリ間を、その生息域の共有、あるいは摂食対象の共有性などを介して行き来している可能があります。
近年ヒトでコウモリ由来感染症が多発する原因として、自然の開発にともない、コウモリと家畜や人の住み分けが保たれなくなった事が挙げられます。後で述べる、マレーシアの二パウイルス感染症では、熱帯や熱帯雨林開発とともに家畜の飼育域(ブタ)がオオコウモリの生息域に入り込んだことが原因ではないかと推測されています。しかし、これまで研究されているコウモリ種はわずかであり(全種の10%くらい)、まだまだ病原体の存在も判っていません。今後も新しい翼手目由来感染症が世界を震撼させる可能は高いといえます。

1994年9月オーストラリア東部のヘンドラ地区の厩舎で突然競走馬が発症し、14頭が死亡しました。このウマでの流行中に感染馬と接触した調教師1名が死亡し、1名が発病後に回復しました。感染したウマの肺とヒトの死亡例の腎臓から、パラミクソウイルス科、へ二パウイルス属のヘンドラウイルスが分離されました。症状はヒト、ウマともに食欲不振、発熱、泡沫性鼻汁、出血性肺炎、間質性肺炎、肺水腫、チアノーゼ、四肢浮腫、運動失調などがみられました。
ヘンドラウイルスの自然宿主を明らかにするため、疫学調査が行われました。哺乳類、爬虫類、両生類、鳥類を含む46種の動物から総計5,550 の血清が検査されましたが、抗体はすべて陰性でした。また流行が約1か月でオーストラリア東部の2地区、マッケイ(1994年8月)とヘンドラ(1994年9月)で起き、両地区は800kmも離れていたので、オオコウモリや渡り鳥が疑われました。調査の結果4種類のオオコウモリがヘンドラウイルス抗体陽性であり、オオコウモリからウマに感染し、ウマからヒトに感染したと考えられました。自然宿主の候補の一つと考えられたハイガシラオオコウモリ8匹の皮下、または経鼻と経口でウイルスを接種した結果、6匹が無症状で抗体が上昇し、2匹は血管病変と高いレベルの抗体を有し、生残し、自然宿主であると結論されました。オオコウモリは常にウイルスを保有していますが、1994年から2013年までの調査では、ウマへの感染が15回、ウマからヒトへの感染が4回起こっています。調査の結果、自然宿主はクロオオコウモリ、メガネオオコウモリ、ハイガシラオオコウモリ、オーストラリアオオコウモリであることが分かりました。

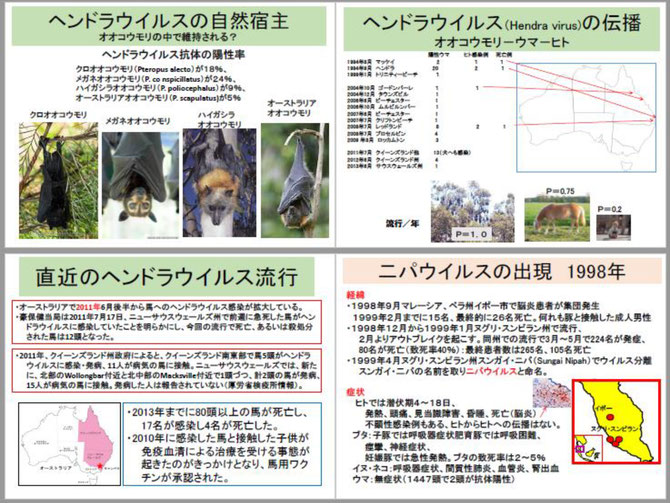
1998年9月マレーシアのペラ州イポー市で脳炎患者が多発し、翌年2月までに15名が死亡し、最終的には26名が死亡しました。1998年12月から翌年1月にヌグリ・スンビラン州で流行が始まり、2月からはアウトブレイクになりました。脳炎患者さんの93%は養豚関係者(42%は労働者、39%は経営者)でした。最初、日本脳炎が疑われましたが、成人に多く、蚊を介する日本脳炎とは流行様式が異なり、ワクチンが効かないことから別のウイルス感染症が疑われました。
1999年3月ヘンドラウイルスに類似のウイルスが分離され、スンガイ・ニパ(Sungai Nipah)村の名前を取りニパウイルスと命名されました。1999年3月~5月の流行では、224名が発症し、80名が死亡しました。疫学調査では、1998年9月~1999年3月の間に急性脳炎として登録された患者さんは265人で、そのうち死亡者は105人でした。265人のうち155人がニパウイルスに感染しており、37人がニパウイルスと日本脳炎ウイルスの両方に感染し、11人が日本脳炎ウイルスに感染するという複雑な状況でした。1999年2月~4月に4発生地域でブタ90万頭を殺処分し、汚染農場検査を進め陽性農場ではブタの全頭殺処分を行った結果、1999年5月に流行は終息しました。その後マレーシアではニパウイルスの流行は見られていません。マレーシアの例では、自然宿主のオオコウモリからニパウイルスがブタに感染し、ブタでウイルスが増幅され、ヒトに感染しました。
他方、2001年~2013年にはバングラディシュでニパウイルス感染症の散発的な流行がみられました。しかし、このケースではブタの関与はありませんでした。夜にオオコウモリが食べに来た果物がコウモリの体液で汚染され、汚染したナツメヤシ等の生ジュースによりヒトへの感染が起きたと考えられています。2004年には病院で医師1名、2010年に研修医1名が患者さんから感染し死亡しています。このケースではオオコウモリから汚染果物を介してヒトに感染し、まれではあるがヒトからヒトに感染したと考えられます。バングラディシュでは総数179名が感染し、140名が死亡しました。また、インドでは2001年と2007年に流行(5人感染、全員死亡)が起きています。ニパウイルスが南アジアに広く分布していること、オオコウモリからブタを経てヒトという感染経路以外に、果物やヒトからヒトへの感染が起こることが明らかになりました。

2002年11月に広州市呼吸病研究所は中華人民共和国広東省で、同年7月頃から新しい急性呼吸器感染症が発生したと発表しました。40℃近くの発熱、咳、胸の痛み、肺炎、呼吸困難、重症者は死亡といった具合で、病勢の経過は非常に早く進行しました。この疾病が一般に知られたのは2003年2月、香港メトロポールホテルで流行が一気に拡大した時です。香港での感染源はホテルの9階に宿泊した広東省の医師でした。彼はホテルを訪れた16人に感染させました。SARSのR0(アールノート)は3くらいです(平均1人から3人に感染を拡大する)。彼のように感染症を一気に広げるヒトをスーパ―スプレッダーといいます。高い濃度のウイルスを体内に持ち、比較的長くウイルスを排出し、他人に感染症をうつしていきます。AIDSの時には、サンフランシスコのガエタン・デュガがスーパースプレッダーとして非常に有名になりました。SARSは、その後、わずか数カ月で世界中に伝播し、2003年7月に制圧宣言が出されるまでの間に8,098人が感染し、774人が死亡しました(死亡率9.6%)。感染症は病型そのままの重症急性呼吸器症候群(SARS)と命名されました。日本では、台湾の医師が感染後、数県を回りパニックになりました。厚生労働省は1類感染症に指定し緊急対応を取りました。現在SARSは2類感染症に入れられています。
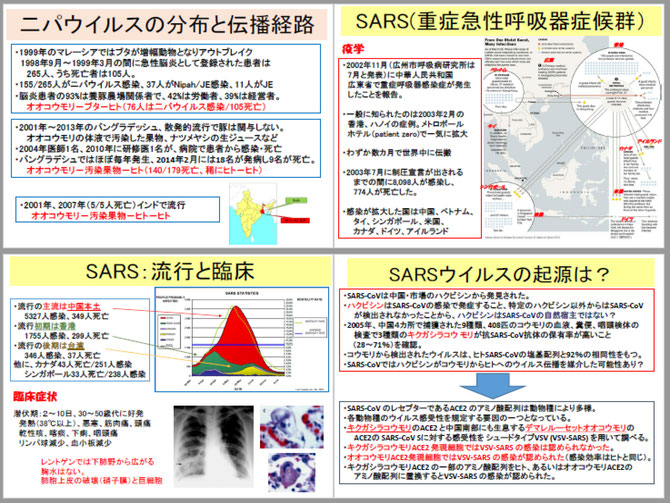
この感染症の原因はSARSコロナウイルスでした。ウイルスは患者と動物市場のハクビシンから発見されましたが、ハクビシンはこのウイルス感染で発症してしまうこと、特定のハクビシン以外からはウイルスが検出されなかったことから、ハクビシンは自然宿主ではないと考えられました。2005年、中国4カ所で捕獲された9種類、408匹のコウモリの血液、糞便、咽頭ぬぐい液の検査で3種類のキクガシラコウモリが抗SARSコロナウイルス抗体の保有率が高いこと(28~71%)、コウモリから検出されたウイルスは、ヒトSARSコロナウイルスの塩基配列と92%の相同性をもっており、キクガシラコウモリが自然宿主と考えられました。
ウイルスが感染するときに必要とする細胞の受容体はACE-2蛋白と同定されました。しかし、キクガシラコウモリのACE-2は受容体としての機能はなく、ヒトやハクビシンのように発症しません。一方、中国南部に生息するデマレルーセットオオコウモリのACE-2は受容体の機能を持っています。ウイルスの生態学から推測すると、生息域を共有するキクガシラコウモリのSARSコロナウイルスが、何らかの理由でデマレルーセットオオコウモリに感染し、ルーセットオオコウモリで増幅し、ハクビシンやヒトに感染した可能性も考える必要があるかもしれません。

2012年9月、サウジアラビアのジェッダで中東呼吸器症候群(MERS)の初発例が報告されました。最初の感染者は6月13日に入院し、6月24日に死亡しました。中東地域で感染が拡大しているこの新型コロナウイルスは、SARSコロナウイルスに近縁のウイルスでした。
2013年8月現在の感染者の確認地域(輸入例も含む)は、サウジアラビア、ヨルダン、カタール、UAE(アラブ首長国連邦)、イギリス、フランス、チュニジア、イタリア(疑い地域はパキスタン、ドバイ)です。2013年12月の調査結果では、潜伏期は2日~14日、肺炎が主な症状で、累計感染者数166人、死亡者数71人(死亡率42.8%)でした。2014年5月のWHOの報告では確定症例が635名で死亡例が193名、致命率は30%でした。ヒト-ヒトへの感染もありますが、家族内など限局的なものや医療関係者が巻き込まれたものです。2015年6月12日のWHOの発表によると、確定患者数は1,289人、死亡者455人で致死率は35.3%です。急激な流行ではありませんが、ジワジワと広がっています。日本では2015年1月21日から2類感染症に分類されました。
2013年8月にMERSコロナウイルスとコウモリの関連を示す論文が発表されました。初発例の男性の自宅近くに生息する食虫コウモリ(エジプシャントゥームバット)から、患者のものと塩基配列が100%一致するウイルスが検出されたというものです。しかし、この時の材料は190塩基の遺伝子断片の解析結果でした。
その後、ヒトの臨床例から、ヒトの感染源となったラクダの血清を2回採取して、その間にMERSコロナウイルスの抗体価が上昇していたために、ラクダがウイルスに感染して間もないことが推測されました。ヨルダン、サウジアラビア、カタール、UAE、エジプトで家畜のウイルス抗体を調査したところ、ヒトコブラクダでMERSコロナウイルス抗体が検出されました。と畜場で集めた110頭の外見健康なヒトコブラクダの鼻ぬぐい液を調べた結果、4頭(3.6%)でMERSコロナウイルスの遺伝子が検出されました。しかし、と畜場の従業員179名はすべて抗体陰性でした。MERSコロナウイルスによる感染がラクダから起きていることが推測されましたが、ラクダが自然宿主とは考えられていません。まだ、このウイルスの自然宿主と増幅動物、感染経路が明確になったという段階ではありません。
中東以外での「輸入感染症」はヨーロッパではイタリア、英国、オーストリア、オランダ、ギリシャ、ドイツ、フランス、トルコで報告があります。アフリカではアルジェリア、エジプト、チュニジアが、アジアではフィリピン、マレーシア、韓国、中国が、北米大陸ではアメリカ合衆国が巻き込まれています。これらの流行はすべて、中東地域への渡航歴のある人もしくはその接触者です。
韓国当局は2015年5月20日、中東帰りの68歳の男性が、MERSコロナウイルスに感染・発症したと発表しました。韓国では、他の輸入感染症を起こした国々と異なり、一気にアウトブレイクの様相を呈しました。何故、韓国でこれほど急速に感染拡大したかは明らかではありません。2015年5月20日が初発例で、約1か月後の6月17日現在、感染者162人、死亡例20人です。想定される原因として、①ウイルスの変異ですが、これは否定的です。極東のヒトがウイルス受容体の高発現・高感受性という可能性は捨てきれません。ウイルスの受容体は、DDP4別名CD26であることが確認されています。②初発患者(ゼロ号患者)さんがスーパースプレッダーであった。③対策の不備、病院のバイオセーフティー教育不備・ベンチレーション不備などです。いずれ疫学調査により、原因が明らかにされるでしょう。

アフリカには末期に全身性の出血を特徴とするフィロウイルス感染症があります。1類感染症のエボラ出血熱(エボラウイルス)とマールブルグ病(マールブルグウイルス)です。どちらもウイルスの自然宿主としてはオオコウモリが考えられています。
欧州でポリオワクチン製造などのために1967年8月ウガンダから輸入したアフリカミドリザルを介して流行が起きたのが、マールブルグ病の最初の報告です。マールブルグのベーリング研究所、フランクフルトのパウル・エールリヒ研究所とベオグラードの血清ワクチン研究所でした。合計31名が発症し、7名が死亡しました。死亡率は22%でした。同時期に日本でも同じ業者から7, 8月に500頭輸入しましたが、幸いマールブルグ病は発生しませんでした。ウガンダから輸入されたミドリザルが、英国の空港で他のアフリカの野生動物、おそらくオオコウモリと接触し、ウイルスを伝播されたものと思われます。
その後の流行は、1960年代後半から1990年代までは小さく散発的でした。1975年に南ア連邦で3名が発病し1名が死亡、1980年にケニアで2名発症、1982年南ア、1987年ケニアで散発的な流行、1990年スエーデンの旅行者が感染、1994年ロシアで実験室内の感染が起こりました。しかし、2000年前後からマールブルグ病の流行は、大規模化する傾向がみられ、死亡率は高くなりました。1999年コンゴで大流行し、103人が感染し、69人が死亡しました。2000年にはコンゴで流行、150人が感染し、原因としてコウモリが疑われました。2004年から05年にかけてアンゴラで流行し、374人が感染し、329人が死亡しました。
マールブルグ病の潜伏期間は3日〜10日で、突然の発熱、頭痛、筋肉痛、皮膚・粘膜での発疹などが初期にみられます。激しい嘔吐が繰り返され、1~2日して水様性下痢がみられます。皮膚の発疹は特徴的で、発症後5~7日で胴体部、臀部、上肢などに境界明瞭な留針の頭部大の暗赤色の丘疹が出現します。重症例では散在性に暗赤色の紅斑が顔面、胴体、四肢に認められます。死亡率は25%位です。
マールブルクウイルスの自然宿主については、2007年にアフリカのオオコウモリが感染の媒介となっていることをガボンと米国の研究チームが突き止めました。ガボンとコンゴ共和国で2005年と2006年に採集したルーセットオオコウモリ283匹のうち4匹からマールブルグ病ウイルスの遺伝子を検出しました。また、同種のコウモリ29匹で抗体陽性が確認されました。霊長類以外で自然感染による陽性反応が出たのは、これが初めてでした。全部で10種類のコウモリ1,100匹について調査しましたが、他の種のコウモリからは、マールブルグ病のウイルス遺伝子も抗体も検出されませんでした。エジプトルーセットオオコウモリが自然宿主と考えられています。

エボラ出血熱は、1976年にスーダンのヌザラとザイール(現コンゴ民主共和国)のエボラ川の近くのヤンプク村での流行が最初です。エボラウイルスは、この川の名前にちなんで名づけられました。マールブルグウイルスが1株なのに対し、エボラウイルスは現在までに5株が分離されています。そのうち4株はアフリカ由来でヒトに致命的な感染を起こします。ザイール株、スーダン株、コートジボワール(タイフォレスト)株、ブンディブギョ株です。エボラウイルスの流行では、野生のチンパンジーが感染し、群れのチンパンジーが絶滅する危惧を持たれたケースや、チンパンジーからヒトに感染したケースなども報告されています。エボラ出血熱は、最初の流行からその規模は比較的大きなものでした。
1976年スーダンでの流行は、284例が感染し、死亡率は53%でした。同年のザイールの流行では318例が感染し、死亡率は88%という高率でした。1994年タイフォレスト株では、チンパンジーが12例感染し、解剖した1人が感染しました。1995年コンゴの流行では315例感染し、死亡率は77%、1996 年のガボンでは91例感染、死亡率70%という状況でした。2000年~2001年のウガンダでは425例感染、224例が死亡、ガボンでは124例感染、69例が死亡しました。その後もほぼ毎年流行が起きています。2007年ウガンダで新種のエボラウイルスによる流行が起きました(ブンディブギョ株)。ウガンダ、ブンディブギョで流行し、37人が死亡しました。2008年の米国疾病予防管理センター(CDC)の発表では、致死率は36%以下で80~90%のザイール株、50~55%のスーダン株より低いこと、既存の株と比べて塩基配列が30%以上も異なっていました。これまでの分離ウイルス株とは別の流行株でした。
アジアの1株は、レストン株でサル類に致命的な感染を起こしますが、なぜかヒトでは感染しても発症しません。サル類での流行は、いずれもフィリピンのサル類繁殖施設(ファーライト)から輸出されたカニクイザルでみられました。1989年バージニア、レストンでの流行が最初で、1990年にテキサス州のアリス、1992年にイタリアのシエナ、1996年にアリスとフィリピンでカニクイザルの間で流行がみられました。
レストン株は2008年7月フィリピンのブタの感染症を調査する中で見つかり世界を驚かせました。感染材料は米農務省プラムアイランド動物疾病センターで解析されました。それまでコウモリとヒト、あるいはサル類でしか見つからなかったウイルスがどのようにブタに感染したのか?ブタを経由する中で病原性が変化するのか?いろいろと疑問が出されましたがまだ解明されていません。ブタからヒトへの感染はありましたが、カニクイザルの時と同様に、ヒトでの発症はありませんでした。

私は、1996年のフィリピンのサル施設におけるレストン株の流行後にフィリピン熱帯医学研究所、フィリピン大学獣医学部と共同研究を始めました。サル繁殖施設での流行疫学、ミンダナオ島のカニクイザルの疫学調査から初めて、その後、野生コウモリに標的を変えました。そして2001年には、我々のグループがこのウイルスの全遺伝子配列を明らかにしました。また、2011年 には多くのフィリピンコウモリの血清を調べた結果、ジュフロワルーセットオオコウモリのみが抗体を持っており、自然宿主である可能性が示唆されました。その後、中東のデマレルーセットオオコウモリがやはり、フィロウイルス抗体を持っていることが報告され、アフリカ、中東、アジアの別種のルーセットオオコウモリが、それぞれ抗体陽性であることが明らかになりました。おそらくアフリカ起源のフィロウイルスが、エジプトルーセットオオコウモリ(アフリカ)、デマレルーセットオオコウモリ(中近東)、ジュフロワルーセットオオコウモリ(アジア)とコウモリとともに東に広がってきたのでしょう。


コウモリ由来の主要な人獣共通感染症はこれで終わりですが、ウイルス以外にも細菌や真菌感染症が知られています。また、人には感染しませんがコウモリの白鼻症候群のような北米のココウモリの真菌感染症が問題になっています。西アフリカのエボラ出血熱の大流行に関しては、「エボラ出血熱3年」に別途載せてあります。

インフルエンザウイルスH18N11亜型が同定されたスリナムのコウモリは、ヒラバナフルーツコウモリで(flat-faced fruit bat)で、学名はArtibeus planirostrisでした。ヒラバナフルーツコウモリは、ヘラコウモリ(Phyllostomidae)科に属し、南米種です。 時にはジャマイカのオオコウモリの亜種と見なされますが、サイズが大きいこと、顔にかすかな縞模様があり、上顎の両側に第3大臼歯があることで区別が可能です。彼らは夜行性で草食性です。ほぼ完全に果食ですが、少量の昆虫やダニを食べることもあります。一晩中活動しており、樹木をねぐらとして日中を過ごします。好まれる果物には、ヴィスミア(Vismia)、イチジク、アマゾンのブドウなどがあります。少なくともいくつかの地域では、雨季に出産するのが一般的ですが、一年を通して繁殖することができるようです。 妊娠期間は少なくとも3ヶ月半続き、1匹の仔が生まれます。
H17N10が同定されたグアテマラのアメリカケンショウコウモリ(little yellow-shouldered bat)の学名は、Sturnira liliumです。アメリカケンショウコウモリは、南アメリカと中央アメリカに生息するコウモリです。 この種は果実食で、効果的な種子散布者です。彼らは樹洞(木のウロ)、枝、葡萄の木、ヤシの葉の下を単独でねぐらとしています。通常は日々同じねぐらを利用します。 外温性で体温調節に合わせて代謝レベルの調整を助ける機構があることを示唆する証拠があります。交配期に関しては、食物の入手可能性よりも、周囲温度がより大きく影響するとして注目されています。また、翼の形状は妊娠期の影響をうけ、より効率的に飛行するようになっている可能性もあります。
2013年11月1日に厚生労働省の動物由来感染症技術研修会で使ったスライドです。
コウモリに由来する感染症はエボラ出血熱、マールブルグ病やヘンドラウイルス感染症、二パウイルス感染症、あるいはSARSやMERS、狂犬病とコウモリリッサウイルス感染症など
いずれも、ヒトに致命的な感染症です。
これまで、ヒトからみたこれら脅威の感染症について説明して来ました。でも、それでは問題の解決にはなりません。ヒトだけは1属1種ですが、コウモリという概念は誤解を生みます。渡り鳥という鳥種がいないように、コウモリという生き物もいません。個々のコウモリ種は、それぞれ独自の生態を持っています。感染症も個々のコウモリ種の振る舞いを知らなければ統御できません。そこで、今回は、見方を変えて、ヒトからではなく、コウモリからみた感染症という視点で考えてみました。
野生動物に由来するヒトの感染症のステージには5段階があるといわれています。翼手目(コウモリ)から、ヒトに来る感染症には狂犬病(ステージ2)、エボラ出血熱(ステージ3)などがあります。
それでは、これらの病原体を運ぶコウモリ(翼手目)は、いつごろ地球上に出現したのでしょうか?約9000万年くらい前に肉食類(イヌ、キツネなど)、偶蹄類(ブタ、ラクダなど)、奇蹄類(ウマなど)から別れ、7000万年くらい前にオオコウモリと小コウモリが分かれたと思われます。
狂犬病ウイルスがキツネや犬、ヘンドラウイルスが馬に、ニパウイルスが豚に、MERSがラクダ?に伝播する性状は、コウモリがこれらの動物と系統的に近縁であるからかもしれません。もっとも古いコウモリの化石(イカロニクテルス)は5300万年前の地層から米国、ワイオミング州で見つかりました。

一言でコウモリ(翼手目)といっても、1100種を超える多様性をもっていて、哺乳類では齧歯類(約2000種)に次ぐ種の多さです。コウモリという言葉でまとめてしまうのは、科学的には間違った解釈になる危険性があります。
体の大きさ、コロニーサイズ、社会性、食性も様々です。小コウモリ(主に食虫コウモリ)には、巨大なコロニー(数百万匹)を作る種があり、洞窟で密に生息する状況は、病原体にとっては有利な温床です。なぜなら、病原体の再生産率(アールノート:R0)は、個体群の規模・密度に比例して大きくなるからです。
ルーセットオオコウモリは、オオコウモリですがエコロケーションができ洞窟にも樹間にも生息します。小コウモリからオオコウモリに病原体を運ぶ役割を果たしているかもしれません。オオコウモリは、熱帯の樹間にカスミ網をかけて捕獲します。小コウモリは、洞窟に入って捕獲します。(詳しくはフィリピンコウモリの項目に載っています)
オオコウモリに載った病原体は、数100キロも移動します。また、オオコウモリは果食なので、オオコウモリが食べた果実を人が食べると、感染することがあります(二パウイルス)。

ヘニパウイルス、コロナウイルス(SARS, MERS)、フィロウイルス、リッサウイルスについて、コウモリ社会でのウイルスの生態と人への感染経路を見てみましょう。
ヘニパウイルスは、オオコウモリに共存し、近縁のウマやブタがウイルスの増幅動物となって、時にヒトを含むアウトブレイクを起こします。(二パウイルスは果物を介して、オオコウモリから人に直接来るケースもあります。まれにヒトからヒトへの感染があります)。
増幅動物を介して流行する場合は、人が巻き込まれると大流行(アウトブレイク)になる可能性があります。果物の場合はウイルスは増幅しないので散発的な流行になるようです。
コロナウイルス(SARS,MERSは沢山のコウモリコロナウイルス群の中の一群です)は小コウモリと共存し、ハクビシン、あるいはラクダを増幅動物?としてヒトに来る可能性が考えられます(まだ、不明な点が多い)。
フィロウイルスはエジプトルーセット、デマレルーセット、ジュフロワルーセットとともに、アフリカからアジアまで分布しています。アフリカでは他のオオコウモリにも伝播しています。おそらく、ルーセットオオコウモリの生息域の拡大とともに、アフリカから中東、アジアへと広がったのでしょう。
リッサウイルスは小コウモリ、オオコウモリの両者と共存し、血清型1型の狂犬病ウイルスが世界中に、主として肉食動物を介して拡散しています。

こうした感染症は、ヒトから研究を進めるだけでなく、コウモリ社会の中でのウイルスの生態学や、コウモリからどのように増幅動物にウイルスが拡散するのか、そのルールがわからなければ、コントロールは困難です。これからの重要な研究テーマです。

微生物検査の教科書を書いた際に、コラムに書いたものです。
授業をしながら、なんとなく考えていたことを短文にまとめました。
「感染症とは?」
新しい大学で、「病原体科学」「感染症概論」「生体防御論」を教えることになり,プリオン、ウイルス、細菌、原虫、真菌、寄生虫など各種病原体をもう一度勉強し直した。感染症概論は疫学から家畜感染症やヒトの感染症、動物由来感染症について整理する機会をもった。生体防御については,系統発生から見た進化免疫論を論じた。
これまで、学生時代に先生から聞いた話に,自分の研究や学会などで聞いた話を付け加え講義をしてきた。しかし、インターネットという強力な武器を手に入れ,これらの学問を,もう一度自分の頭で考え,整理してみると全く違うものがみえてきた。その一部は本書(微生物検査の教科書)で担当した項目で述べた。わかったことは,当たり前のことだが,これらの学問は人間を中心に作られたもので,ヒト,特に医者の目でみた学問だということである。
例えば「感染症」とはいったい何であろうか?その病原体(細菌,真菌,原虫など)は地球上に初期に出現した生命体群で,一方,宿主(家畜やヒト)は,最後に出現したグループである。我々はこの両者の相互作用を感染症という。
しかし、地球の生命史の約半分の時間(20億年)は原核生物(真正細菌と古細菌)の世界であった。残りのさらに半分(10億年)は単細胞生物(真核生物のうち、原生生物や単細胞真菌)の世界で,気の遠くなるような長い時間,原虫群と細菌群の相互作用(感染)があったことだろう。約10億年前に多細胞生物が出現するが,高等生物はカンブリア紀(約5~6億年前)にやっと出現した。初期の生命体は新しい宿主をみつけることとなった。特に鳥類や哺乳類のような恒温動物は,病原体にとっては格好の培地であり,豊富な栄養源と安定した体温は、微生物の増殖には最適といえる。他方、また宿主もそれに対応して、より複雑な免疫系を確立することとなった。だが我々ヒトが登場するずっと前から,いや地球上に生命体が出現した時から,生命体間の相互作用(感染症)は存在したはずである。
生物学においては微生物(肉眼でみえない病原体群),原虫(病原性のある原生動物群?),寄生虫(宿主と共生する多細胞生物群?)という分類は存在しない。これは、生物学が生物の視点に立ち、医学が人の視点に立っていること、生物学と医学の視点が違うためであろう。動物由来感染症や家畜感染症の統御を考えると,ヒトの視点とは異なる生物学的な視点で、病原体の生態学的振る舞い(生命体の相互作用)を知る必要があるのではないだろうか?(コウモリと感染症で、ヒトからみたコウモリ由来感染症でなく、コウモリから見た感染症を論じたいといったのは、この考えの入り口である)。
 吉川泰弘の
ホームページへようこそ!
吉川泰弘の
ホームページへようこそ!








